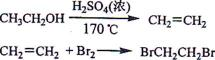- 化学实验
- 共767题
实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
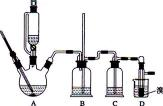
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
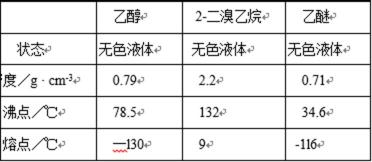
有关数据列表如下:
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应
b.加快反应速度
c.防止乙醇挥发
d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a,水
b,浓硫酸
c,氢氧化钠溶液
d,饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a,水
b,氢氧化钠溶液
c,碘化钠溶液
d,乙醇
(6)若产物中有少量副产物乙醚,可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
正确答案
(1)d
(2)c
(2)溴的颜色完全褪去
(4)下
(5)b
(6)蒸馏
(7)避免溴大量挥发;产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管。
解析
(1)因“乙醇在浓硫酸的存在下在l40℃脱水生成乙醚”,故迅速地把反应温度提高到170℃左右的原因是减少副产物乙醚生成。
(2)因装置C的“目的是吸收反应中可能生成的酸性气体”,故应选碱性的氢氧化钠溶液。
(3)是用“少量的溴和足量的乙醇制备1,2—二溴乙烷”,反应结束时溴已经反应完,明显的现象是溴的颜色褪尽。
(4)由表中数据可知,1,2-二溴乙烷的密度大于水,因而在下层。
(5) Br2能与氢氧化钠溶液反应,故可用氢氧化钠溶液洗涤;虽然也能与碘化钠溶液反应,但生成的I2也溶于1,2-二溴乙烷。
(6)根据表中数据,乙醚沸点低,可通过蒸馏除去(不能用蒸发,乙醚不能散发到空气中)。
(7)溴易挥发,冷水可减少挥发。但如果用冰水冷却会使产品凝固而堵塞导管。
知识点
现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量
(1)制备一氧化碳的化学方程式是 ;
(2)试验中,观察到反应管中发生的现象是 ;
尾气的主要成分是 ;
(3)反应完成后,正确的操作顺序为 (填字母)
a,关闭漏斗开关 b,熄灭酒精1 c,熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为 ;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节) ;
②写出有关反应的化学方程式 。
正确答案
见解析。
解析
(1)制备一氧化碳的化学方程式是
(2)试验中,观察到反应管中发生的现象时黑色粉末变红;尾气的主要成分是CO CO2; 实验步骤: 先通入CO一会儿后 加热后 停止加热 然后继续通入CO到玻璃管冷却为止故反应完成后,正确的操作顺序为 熄灭酒精灯2,然后关闭漏斗开关 ,最后熄灭酒精1 。
(3)acb
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g, 剩余固体全部为铜,原样品中单质铜的质量分数为 4.8÷5=0.96 ;
(5)用蒸馏水稀释浓HNO3,与一定样品反应,使样品完全反应,收集产生的NO气体,并在标况下测其体积。
要测定铜的质量分数,可以把浓硫酸稀释,铜和稀硫酸不反应,氧化铜和稀硫酸反应,即可求出铜的质量分数。设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可。反应的化学方程式为CuO+H2SO4=CuSO4+H2O
知识点
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。
完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是 (填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠 g(保留一位小数);如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 g (保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图:
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
已知:
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 。
和碱法相比,石灰-石膏法的优点是 ,缺点是 。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
正确答案
见解析。
解析
(1)用硫酸和亚硫酸纳反应制取二氧化硫利用固液不加热制取气体装置,因此,选ae
(2)
解得m=18.9g
设样品质量为100g,变质的亚硫酸钠为40g,生成硫酸钠的质量为45.1g,则这时亚硫酸钠的质量分数为
(3)酸性氧化物与碱的反应。便宜,成本低;吸收慢,效率低。
(4)
知识点
实验室制取少量溴乙烷的装置如图所示。根据题意完成下列填空:
(1)圆底烧瓶中加入的反应物是溴化钠、________和1:1的硫酸。配制体积比1:1的硫酸所用的定量仪器为________(选填编号)。
a. 天平
b. 量筒
c. 容量瓶
d. 滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式________。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是________。
试管A中的物质分为三层(如图所示),产物在第________层。
(4)试管A中除了产物和水之外,还可能存在________、________(写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是________(选填编号)。
a. 蒸馏
b. 氢氧化钠溶液洗涤
c. 用四氯化碳萃取
d. 用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是________。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:________。
正确答案
(1)乙醇;b
(2)NaBr+H2SO4

(3)冷却、液封溴乙烷;3
(4)HBr;CH3CH2OH
(5)d;乙烯
(6)反应会产生Br2,腐蚀橡胶
解析
本题主要考察溴乙烷的制备、提纯、有机反应等复杂性以及实验安全等。
(1)(2)实验室制取少量溴乙烷所用试剂是乙醇和溴化氢反应;溴化氢可利用溴化钠和硫酸反应制得。配制一定体积比的硫酸使用量筒即可,因为该浓度不是物质的量浓度并且不需要非常精确,因此不需要使用滴定管。
(3)(4)溴乙烷的密度比水大且不溶于水,冰水混合物的作用是冷却、液封溴乙烷,第三层为溴乙烷,最上层有可能是副反应产生的乙醚等杂质、第二层是挥发的HBr、乙醇等的水溶液。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,说明含有溴单质,由于溴乙烷与溴均易挥发,且均易溶于有机物,因此不能使用蒸馏或萃取的方法,二者均能与氢氧化钠溶液反应,不也不能使用氢氧化钠洗涤,用亚硫酸钠可将溴进行还原从而进行洗涤。
(6)生成的溴会腐蚀橡胶。
知识点
某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物制备溴乙烷,检验反应的部分副产物,并探究溴乙烷的性质。
(一) 溴乙烷的制备及产物的检验:设计了如图一装置,其中夹持仪器、加热仪器及冷却水管略去。请根据实验步骤,回答下列问题:
(1)仪器E的作用是________________ ,
(2)制备操作中,加入少量水,其目的是_______(填字母)。
a.减少副产物烯和醚的生成
b.减少Br2的生成
c.减少HBr的挥发
d.水是反应的催化剂
(3)加热片刻后,A中的混合物出现橙红色,该橙红色物质可能是____________
(4)理论上,上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等
① 检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直E上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验。B、C中应盛放的试剂分别是________、__________
② 检验副产物中是否含有乙醚:某同学通过红外光谱仪鉴定所得产物中含有“-CH2CH3”基团,确定副产物中存在乙醚。请你对该同学的观点进行评价:_________________。
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是____________。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(二)溴乙烷性质的探究:
用图二实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
Ⅰ:在试管中加入10 mL6mol/L NaOH溶液和2 mL 溴乙烷,振荡。
II:将试管如图固定后,水浴加热。
(6)观察到________现象时,表明溴乙烷与NaOH溶液已完全反应。
(7)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图三装置。
A试管中的水的作用是______,无A试管,B试管中的试剂应为______________。
正确答案
(1)冷凝、回流
(2)abc
(3)Br2
(4)①苯(或四氯化碳等有机溶剂)、硝酸银或石蕊试液
②不正确;溴乙烷中也含乙基
(5)c
(6)液体不分层(均匀溶液)
(7)吸收乙醇(HBr);溴水
解析
略
知识点
6.化学与科学、技术、社会、环境密切相关。下列说法中,你认为正确的是:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6. 化学与生活密切相关,下列说法或做法合理的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.化学在生产和生活中有着广泛的应用,下列做法
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.化学与工农业生产、环境保护、日常生活等方面有广泛的联系,下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
工业上从废铅蓄电池的铅膏回收铅的过程中,可用碳酸盐溶液与处理后的铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32—(aq) 
(1)上述反应的平衡常数表达式:K =_______。
(2)室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在______溶液中PbSO4转化率较大,理由是________。
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3•Pb(OH)2],它和PbCO3受热都易分解生成PbO。该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,请你完成假设二和假设三:
假设一:全部为PbCO3;
假设二:___________;
假设三:__________。
(4)为验证假设一是否成立,课题组进行如下研究。
①定性研究:请你完成下表中内容。
②定量研究:取26.7 mg的干燥样品,加热,测得固体质量随温度的变化关系如下图。某同学由图中信息得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:____。
正确答案
(1)
(2) Na2CO3 Na2CO3溶液中c(CO32-)较大
(3)全部为PbCO3•Pb(OH)2 PbCO3与PbCO3•Pb(OH)2的混合 物
(4)①
②同意 若全部为PbCO3,26.7 mg完全分解后,其固体质量为22.3 mg (不同意,实验最终得到固体的质量与全部为PbCO3分解所得固体质量相差不大,可能是实验过程中产生的误差引起的)
解析
略
知识点
某研究小组利用题9图装置探究温度对CO还原Fe2O3的影响(固定装置略)
(1)MgCO3的分解产物为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按题9图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
①乙组得到的黑色粉末是 。
②甲组步骤1中反应的离子方程式为 。
③乙组步骤4中,溶液变红的原因为 ,溶液褪色可能的原因及其验证方法为 。
④从实验安全考虑,题9图装置可采取的改进措施是 。
正确答案
见解析。
解析
(1)难溶的碳酸盐受热易分解为氧化物和CO2,因此MgCO3受热分解得到产物是MgO与CO2。
(2)结合实验目的可知在装置B处,CO2与Zn作用生成CO气体,进入后面装置进行实验,故装置C中NaOH是用来吸收CO中混有的CO2气体;CO气体不一定完全反应,因此尾气中会有CO,可利用其可燃性采取点燃法来进行尾气处理。
(3)①利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”可知用酒精喷灯的乙组实验得到的固体为Fe;②利用甲组现象可知Fe2O3与CO在酒精灯加热的条件下,Fe2O3被还原得到黑色固体为Fe3O4,由此可写出反应的离子方程式;③因Fe3+遇SCN-显红色,所以步骤4中溶液变红是溶液中Fe2+被Cl2氧化为Fe3+所致、溶液褪色的原因可能是Cl2将SCN-氧化,若该假设成立,则溶液中还存在Fe3+,再继续加入KSCN溶液则溶液变红;④若B处停止加热后,C中液体易倒吸入B中引起玻璃管炸裂,因此可采取的改进措施是在装置B C之间添加装置E防倒吸。
知识点
用下图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
正确答案
解析
分析装置知,①小烧杯中液体与②小烧杯中挥发出来的物质反应。A项,②烧杯里浓硝酸挥发出硝酸气体,进入①烧杯,使KI被氧化生成I2,4HNO3+2KI=I2+2KNO3+2NO2↑+2H2O,I2使淀粉溶液变蓝色,A项错误;B项,浓盐酸具有强挥发性,挥发出来的氯化氢进入酚酞溶液,酸不能使酚酞溶液变色,B项正确;C项,浓氨水具有强挥发性,氨气进入氯化铝溶液,发生反应:AlCl3+3 NH3·H2O=Al(OH)3↓+3NH4Cl,产生白色沉淀,C项正确;D项,饱和氯水易挥发出来氯气,氯气遇湿润红纸条,发生反应:H2O+Cl2
知识点
请设计CO2在高温下与木炭反应生成CO的实验。
(1)在下面方框中,A表示有长颈漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置,连接胶管及尾气处理不分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如下:
(2)根据方框中的装置图,在答题卡上填写该表
(3)有人对气体发生器作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中。改进后的优点是 ;
(4)验证CO的方法是 。
正确答案
(1)
(2)
(3)可以通过控制加酸的量,来控制气体产生的快慢;同时小试管中充满盐酸,可以起到液封的作用,防止反应剧烈时气体经漏斗冲出
(4)点燃气体,火焰呈蓝色,再用一个内壁附着有澄清石灰水的烧杯罩在火焰上,烧杯内壁的石灰水变浑浊
解析
(1)这里与一般的物质制备思路是一致的,思路是先制备CO2,再净化除杂,干燥,接着再与C在高温下反应制CO,再除去未反应完的CO2,
(4)此问答案很多可以点燃,看火焰看产物;也可以E后面再接个灼热CuO的玻璃管后面再接个放澄清石灰水的洗气瓶,看玻璃管和石灰水的现象;也可应直接用PdCl2溶液等
知识点
下列实验操作能达到目的的是
正确答案
解析
略
知识点
扫码查看完整答案与解析