- 金属防护的常用方法
- 共14题
6.根据实验操作和现象所得出的结论正确的是( )
正确答案
解析
A.比较非金属性,应根据最高价氧化物的水化物的酸性,不能够用盐酸,可用高氯酸,故A错误; B.向2mL 0.1mol/L MgCl2溶液中加入2mL 1mol/L 的NaOH.观察到白色沉淀后加入2滴FeCl3,静置,出现红褐色沉淀,氢氧化钠过量,不发生沉淀的转化,故B错误;C.KSCN与Fe3+作用使溶液显红色,只能说明含Fe3+,不能说明无Fe2+,故C错误;D.乙烯能够被酸性高锰酸钾溶液氧化,发生的是氧化反应,二氧化硫具有还原性,能被强氧化剂氧化,褪色原理相同,故D正确.故选D.
考查方向
解题思路
A.比较非金属性,应根据最高价氧化物的水化物的酸性; B.氢氧化钠过量,不发生沉淀的转化;C.KSCN与Fe3+作用使溶液显红色;D.乙烯能够被酸性高锰酸钾溶液氧化,发生的是氧化反应,二氧化硫具有还原性,能被强氧化剂氧化.
易错点
没注意到要用最高价含氧酸的酸性来比较非金属性的强弱
知识点
下图是工业上以天然气、空气为原料合成氨的一种工艺流程:
15.脱硫反应第一步是利用Fe(OH)3除去H2S,该反应的化学方程式是 。
常温下,Fe(OH)3在水中达到溶解平衡时,c(Fe3+)= mol·L-1。(已
知:Ksp[Fe(OH)3]=2.6×10-39)
16.脱硫反应第二步是利用空气氧化回收硫,该反应中氧化剂与还原剂的物质的量之比为 。下列试剂中也适宜作此反应的氧化剂的是 。
A.Cl2
B.H2O2
C.KMnO4
D.O3
17.流程中Fe(OH)3和K2CO3可循环利用,你认为流程中还可循环利用的物质有 (填化学式)。
18.合成氨反应的化学方程式为:
原料气中V(N2):V(H2)=1:3。平衡混合物中氨的含量与温度、压强的关系如图所示。A、B、C三点对应的化学平衡常数KA、KB、KC的关系是 (用“>”、“<”或“=”表示)。A点H2的平衡转化率为 。
19.工业上合成氨通常在反应未达到平衡时就将反应混合物移出合成塔,原因是 。
正确答案
3H2S+2 Fe(OH)3=Fe2S3 +6 H2O 2.6×10-18
解析
根据图信息脱硫反应第一步是利用Fe(OH)3与H2S反应生成Fe2S3 和H2O即:3H2S+2 Fe(OH)3=Fe2S3 +6 H2O; 常温下已知:Ksp[Fe(OH)3]=2.6×10-39 ,Fe(OH)3在水中达到溶解平衡时,其Fe(OH)3溶解平衡为Fe(OH)3(s) 


考查方向
解题思路
根据图信息脱硫反应第一步是利用Fe(OH)3与H2S反应生成Fe2S3 和H2O即:3H2S+2 Fe(OH)3=Fe2S3 +6 H2O; 常温下已知:Ksp[Fe(OH)3]=2.6×10-39 ,Fe(OH)3在水中达到溶解平衡时,其Fe(OH)3溶解平衡为Fe(OH)3(s) 

易错点
溶解平衡常数的应用及计算、化学平衡常数的影响、氧化还原反应的计算;
正确答案
3︰2 B D
解析
据图信息脱硫反应第二步是利用空气氧化回收硫反应方程式为:2Fe2S3 +3O2 +6H2O==6S + 4Fe(OH)3 ;可求出氧化剂与还原剂的物质的量之比;另选适宜试剂作此反应的氧化剂,原则是不引入新的杂质,因此可以是B.H2O2 和 D.O3
考查方向
解题思路
据图信息脱硫反应第二步是利用空气氧化回收硫反应方程式为:2Fe2S3 +3O2 +6H2O==6S + 4Fe(OH)3 ;可求出氧化剂与还原剂的物质的量之比等于计量数之比即为n(O2):n(Fe2S3)=3:2;另选适宜试剂作此反应的氧化剂,原则是不引入新的杂质,因此可以是B.H2O2 和 D.O3 故答案为BD
易错点
溶解平衡常数的应用及计算、化学平衡常数的影响、氧化还原反应的计算;
正确答案
N2 和H2
解析
合成氨气的反应为可逆反应,不能完全转化;因此可循环使用。
考查方向
解题思路
合成氨气的反应为可逆反应,不能完全转化;因此可循环使用。故答案为:3:2 ;N2和H2
易错点
溶解平衡常数的应用及计算、化学平衡常数的影响、氧化还原反应的计算;
正确答案
KA>KB =KC 66.7%
解析
合成氨反应N2 +3H2 
n%=V%= 
H2的转化率=

考查方向
解题思路
合成氨反应N2 +3H2 
应为放热反应,对于此反应平衡常数只与温度有关,B、C点温度相同,即KB =KC ,A点温度更低,平衡向正向进行,即KA>KB =KC,利用化学平衡的三步分析法。可求A点时:n%=50%
H2的转化率=
易错点
溶解平衡常数的应用及计算、化学平衡常数的影响、氧化还原反应的计算;
正确答案
能提高单位时间氨产量(或提高生产效率)
解析
工业上合成氨通常在反应未达到平衡时就将反应混合物移出合成塔,其原因为提高单位时间内氨气的生成速率,即提高生产效率,使生产效益最高。故答案为能提高单位时间氨产量(或提高生产效率)
考查方向
解题思路
工业上合成氨通常在反应未达到平衡时就将反应混合物移出合成塔,其原因为提高单位时间内氨气的生成速率,即提高生产效率,使生产效益最高。
易错点
溶解平衡常数的应用及计算、化学平衡常数的影响、氧化还原反应的计算;
以NaCl为主要成分的融雪剂会腐蚀桥梁、铁轨等钢铁设备。某研究小组探究NaCl
溶液对钢铁腐蚀的影响。
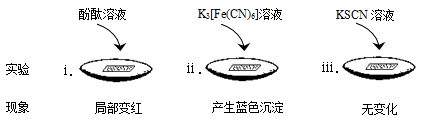
26.将滤纸用3.5%的NaCl溶液润湿,涂上铁粉、碳粉的混合物,贴在表面皿上。在滤纸上加几滴检验试剂,再缓慢加入NaCl溶液至没过滤纸,操作如下所示:
① 实验ⅰ的现象说明,得电子的物质是 。
② 碳粉的作用是 。
③ 为了说明NaCl的作用,需要补充的对照实验是 。
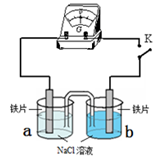
27.向图示装置的烧杯a、b中各加入30 mL 3.5%的NaCl溶液,
闭合K,指针未发生偏转。加热烧杯a,指针向右偏转。
①取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色
沉淀,b中无变化,b中铁片作 极。
②加热后,指针发生偏转的原因可能是 。
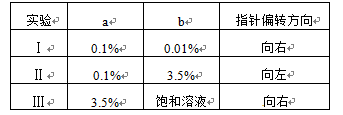
28.用图示装置探究不同浓度NaCl溶液对钢铁腐蚀的影响,
向烧杯a、b中各加入30 mL不同质量分数的NaCl溶液,实验记录如下表所示。
①Ⅱ中,b中电极发生的电极反应式是 。
② Ⅲ中,铁在饱和NaCl溶液中不易被腐蚀。
查阅资料可知:在饱和NaCl溶液中O2浓度较低,钢铁不易
明: 。
29.根据上述实验,对钢铁腐蚀有影响的因素是 。
正确答案
(1)① O2 (2 分)
② 与铁组成原电池,作原电池的正极 
③ 用水代替NaCl溶液进行上述实验 (2 分)
解析
①铁、碳以氯化钠溶液为电解质形成原电池,酚酞变红说明生成氢氧根离子,发生吸氧腐蚀;
②铁与碳以氯化钠溶液为电解质形成原电,铁做原电池负极,碳做正极,故答案为:与铁组成原电池,作原电池的正极;
③为了说明NaCl的作用,需要补充的对照实验是,用水做电解质,代替氯化钠进行上述实验,故答案为:用水代替NaCl溶液进行上述实验;
考查方向
金属的腐蚀原理
解题思路
铁、碳以氯化钠溶液为电解质形成原电池,发生吸氧腐蚀生成氢氧根离子
易错点
验证NaCl溶液的对照试验
教师点评
金属的腐蚀以吸氧腐蚀最为常见,题目难度不大
正确答案
(2)① 正 (1 分)
② 温度升高,Fe还原性增强 ,反应速率加快 (2 分)
解析
①K3[Fe(CN)6]溶液与二价铁离子反应生成蓝色沉淀,而取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色沉淀,说明a中生成二价铁离子,b中无变化,b中没有二价铁离子生成,所以a做负极,b做正极;
②加热后,指针发生偏转的原因可能是:温度升高,Fe还原性增强,反应速率加快;
考查方向
金属腐蚀速率的影响因素
解题思路
①K3[Fe(CN)6]溶液与二价铁离子反应生成蓝色沉淀;
②温度升高,Fe还原性增强,反应速率加快;
易错点
K3[Fe(CN)6]溶液与二价铁离子反应生成蓝色沉淀
教师点评
通过实验探究正确判断出双液原电池的正负极是解题的关键,题目难度不大
正确答案
(3)① Fe-2e- = Fe2+ (2 分)
②另取两个烧杯,分别往其中加入铁片和一定量的饱和NaCl溶液,再分别滴加几滴
K3Fe(CN)6溶液,然后往其中一个烧杯中通入O2,观察现象。 (2 分)
解析
①依据图表中Ⅱ组数据及指针向左偏转,则可知:b极为负极,失去电子发生氧化反应,电极反应式:Fe-2e-=Fe2+;
②要证明氧气浓度对金属腐蚀速率的影响,可以设计对比实验,如下:另取两个烧杯,分别往其中加入铁片和一定量的饱和NaCl溶液,再分别滴加几滴K3Fe(CN)6溶液,然后往其中一个烧杯中通入O2,观察现象;
故答案为:另取两个烧杯,分别往其中加入铁片和一定量的饱和NaCl溶液,再分别滴加几滴K3Fe(CN)6溶液,然后往其中一个烧杯中通入O2,观察现象;
考查方向
金属腐蚀速率的影响因素
解题思路
①依据不同浓度下,检流计指针偏转方向判断电极,书写电极反应式;
②要证明在饱和NaCl溶液中O2浓度较低,钢铁不易被腐蚀,可以设计对比试验,一个实验中通入氧气,另一个实验中不通入氧气,观察铁的腐蚀情况;
易错点
实验设计严密性
教师点评
由(2)中得出,电流计指针向右偏转,b为正极的结论,根据图表中指针偏转方向很容易判断出正负极,题目难度不大
正确答案
(4)温度、NaCl溶液的浓度、O2的浓度 (2 分)
解析
通过上述实验可知:对钢铁腐蚀有影响的因素是有温度、NaCl溶液的浓度、O2的浓度;
考查方向
归纳结论
解题思路
依据上述实验总结归纳解答
易错点
O2的浓度
教师点评
对探究实验做出一个正确的结论归纳,题目难度不大
9.右图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说
法正确的是
正确答案
解析
都是短周期元素,由最外层电子数与原子序数关系可知,X、Y处于第二周期,X的最外层电子数为6,故X为O元素,Y的最外层电子数为7,故Y为F元素;Z、R、W处于第三周期,最外层电子数分别为1、6、7,故Z为Na元素、R为S元素、W为Cl元素,
A.同周期元素从左到右非金属性逐渐增强,应为Cl>S,故A错误;
B.X与R形成的分子可为SO2或SO3,分子内只存在极性键,故B错误;
C.X、Z形成的化合物如为Na2O2,可含有共价键,故C正确;
D.核外电子排布相同的离子核电荷数越大离子半径越小,半径Cl-<S2-,故D错误
考查方向
原子结构与元素周期律
解题思路
都是短周期元素,由最外层电子数与原子序数关系可知,X、Y处于第二周期,X的最外层电子数为6,故X为O元素,Y的最外层电子数为7,故Y为F元素;Z、R、W处于第三周期,最外层电子数分别为1、6、7,故Z为Na元素、R为S元素、W为Cl元素,结合对应单质、化合物的性质以及元素周期律知识解答该题
易错点
D项中离子半径的比较
教师点评
本题考查原子结构与元素周期律知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,难度不大
知识点
扫码查看完整答案与解析