- 键能、键长、键角及其应用
- 共10题
2.下列离子中半径最大的是
正确答案
知识点
11.下列有关物质性质的比较,错误的是( )
正确答案
解析
在碳酸钠饱和溶液中通入二氧化碳生成碳酸氢钠,可观察到溶液变浑浊,说明碳酸钠溶解度大于碳酸氢钠,故A正确;
卤代烃的密度比水大,则溴乙烷的密度大于水,故B正确;
晶体硅与金刚石都为原子晶体C﹣C>Si﹣Si,原子晶体中,键长越短,键能越大,则硬度越大,故C正确;
苯中碳碳键介于单键和双键之间,碳碳键键长:乙烯<苯,故D错误.
考查方向
解题思路
相同条件下,碳酸钠溶解度大于碳酸氢钠;
卤代烃的密度比水大;
原子晶体中,键长越短,键能越大,则硬度越大;
苯中碳碳键介于单键和双键之间.
易错点
本题考查元素及其对应单质、化合物的性质的递变规律,侧重于溶解度、硬度、密度等性质的考查,题目难度不大,注意把握性质比较的角度以及规律.
知识点
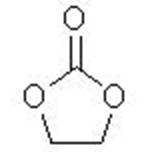
7.碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如下图。下列有关该物质的说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
19.短周期元素X、Y、Z、W在周期表中的位置关系如图所示。已知在同周期元素的常见简单离子中,W的离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
(1)X元素在元素周期表中的位置是____________________。
(2)X、Y、Z元素的氢化物均有两种或两种以上。
①液态YH3的电离方式与液态H2Z类似,则液态YH3中阴离子的电子式为____________ ___________________________;
②在一定条件下X2H4与H2Z可发生反应,化学方程式为__________________________, 反应类型为_____________________________。
(3)以W为材料制成的容器在空气中具有自我保护作用,这种容器不能贮存强碱溶液,用离子方程式表示其原因为____________________________________________。
(4)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为_________________________________。
正确答案
(1)第二(或2)周期ⅣA 族
(2)①
②
(3)
(4)
解析
解析已在路上飞奔,马上就到!
知识点
25.回答下列问题:
(l)已知

(2)Mg存在于叶绿素中,某些作物生长时需要输镁肥,从海水中提取镁是获得镁的主要来源。常温下,已知Mg(OH)2的Kap=l.6x10-11,某浓缩海水中Mgcl2浓度为1.6xl0一3mol/L,则要使Mg2+形成Mg(OH)2沉淀,则溶液的pH至少要达到 。
(3)将A(g)和B(g)按物质的量比为1:1通入到体积为2L的恒容密闭容器中,进行反应A(g)+B(g)
①上述反应为 (填“吸热”或“放热”)反应;
②计算在650℃下,从开始到平衡的反应速率v(A)=
③在900℃下该反应的平衡常数为 (保留三位有效数字),若平衡后保持温度不变向容器中继续充入2molA、lmolM和lmolN,这时平衡移动 (填“正向”、“逆向”、“不”);
④若650℃时,在同样容器中起始时充入的A和B的物质的量均为 2mol,则下图中 是B物质平衡时对应的点。
正确答案
解析
(1)设断开P-P键吸收的能量为x, 6x+3×498-12×360 =- 1632 X=199
(2)Ksp=c(Mg2+)xc2(OH-)=1.6xl0一3mol/L x c2(OH-)= l.6x10-11
c(OH-)= l0一4 mol/L PH=10
(3)①、由图像可知,温度升高,B的物质的量增多,说明平衡逆移,反应放热。
②、由图可知650℃下,从开始到平衡的时间为5min,B变化的物质的量浓度为(4-1)mol/2L=1.5mol/L
v(A)=v(B)=1.5mol/L÷5min=0.3mol/(L.min)
③、900℃ A(g)+B(g)
起始浓度(mol/L) 2 2 0 0
变化浓度(mol/L) 1.25 1.25 1.25 1.25
平衡浓度(mol/L) 0.75 0.75 1.25 1.25
K=2.66
通入2molA、lmolM和lmolN Qc=1.4< K 平衡正移
④、650℃时,在同样容器中起始时充入的A和B的物质的量均为 2mol,压强减小,但该反应是反应前后气体分子数目不变的反应,压强变化平衡不移动,反应速率减慢。B的量所谓原来的一半为0.5mol,到达平衡的需要的时间长,为c点
考查方向
本题考查了化学平衡常数的计算以及应用,平衡移动的影响因素,溶度积常数的应用,键能的计算等知识点。
解题思路
见解析。
教师点评
本题考查了化学平衡常数的计算以及应用,平衡移动的影响因素,溶度积常数的应用,键能的计算等知识点。以及学生的计算能力,图像分析能力等,在高考中出现频率高。
知识点
氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是_________。
a. N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量
b. P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c. 基态As原子中,电子占据的最高能级为4d
d. Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是_________。向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有_________和_________。
(3)PC13分子中,Cl—P—Cl键的键角_________109°28′(填“>”“<”或“=”)。
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。己知该晶体的密度为pg·cm-3,晶胞的边长为acm,则阿伏加德罗常数为_________mol-1(用含p、a的式子表示)。
正确答案
(1)b
(2)NH3分子与水分子之间能够形成氢键;离子键;配位键
(3)<
(4)496/(ρa3)
解析
略。
知识点
关于键长、键能和键角的说法中不正确的是
正确答案
解析
略
知识点
PH3一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是
正确答案
解析
本题考查化学键、分子构型。意在考查考生分子结构的知识。PH3同NH3构型相同,因中心原子上有一对孤电子对,均为三角锥形,属于极性分子,故A、B项正确;PH3的沸点NH3,是因为NH3分子间存在氢键,C项错误;PH3的稳定性低于NH3,是因为N-H键键能高,D项正确。
知识点
已知:P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ∙mol—1,P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ∙mol—1,P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ∙mol—1,PCl3中P-Cl键的键能为1.2c kJ∙mol—1。下列叙述正确的是
正确答案
解析
原子半径P>Cl,因此P-P键键长大于P-Cl键键长,则P-P键键能小于P-Cl键键能,A项错误;利用“盖斯定律”,结合题中给出两个热化学方程式可求出Cl2(g)+PCl3(g)=PCl5(g)△H=(b-a)/4KJ·mol-1,但不知PCl5(g)=PCl5(s)的△H,因此无法求出Cl2(g)+PCl3(g)=PCl5(s)的△H,B项错误;利用Cl2(g)+PCl3(g)=PCl5(g)△H=(b-a)/4KJ·mol-1可得E(Cl-Cl)+3×1.2c-5c=(b-a)/4,因此可得E(Cl-Cl)=(b-a+5.6c)/4kJ·mol-1,C项正确;由P4是正四面体可知P4中含有6个P-P键,由题意得6E(P-P)+10×(b-a+5.6c)/4-4×5c=b,解得E(P-P)=(2.5a-1.5b+6c)/6 kJ·mol-1,D项错误。
知识点
氮族元素化合物在医药、纳米材料制备中应用广泛。
40.P元素的基态电子电子排布式为
41.白磷的分子式为P4,其结构如下图所示,科学家目前合成了 N4分子, N 原子的杂化轨道类型是 ,N—N—N 键的键角为 ;
42.N、P、As原子的第一电离能由大到小的顺序为 。
44.立方氮化硼晶体的结构如下图所示:N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是 ;立方砷化镓晶体的晶胞边长为a pm,则其密度为 g·cm-3 (用含a的式子表示,设NA为阿伏加德罗常数的值)。
正确答案
1s22s22p63s23p3 或Ne3s23p3
解析
P原子核外有15个电子,根据构造原理书写基态P原子核外电子排布式为1s22s22p63s23p3
故答案为:1s22s22p63s23p3
考查方向
解题思路
P原子核外有15个电子,根据构造原理书写基态P原子核外电子排布式
易错点
书写电子排布式的方法不掌握
正确答案
sp3 60°
解析
N4分子中每个N原子价层电子对个数是4且含有一对孤对电子对,根据价层电子对互斥理论判断N原子杂化方式为sp3;该分子结构和白琳分子结构相同,为正四面体结构,键角为60度。
考查方向
解题思路
N4分子中每个N原子价层电子对个数是4且含有一对孤对电子对,根据价层电子对互斥理论判断N原子杂化方式;该分子结构和白琳分子结构相同,为正四面体结构
易错点
杂化类型不会判断
正确答案
N>P>As
HNO3 NO3— V形
解析
同主族元素,元素第一电离能随着原子序数增大而减小,故第一电离能N>P>As
故答案为:N>P>As
[来源:学.科.网Z.X43.HNO3、HNO2是氮元素形成的含氧酸,酸性较强的是 ,酸根中没有孤对电子的是 ,NO2—空间构型是 。
同一非金属元素形成的含氧酸中,非羟基O原子个数越多该酸酸性越强,硝酸分子中非羟基氧原子个数大于亚硝酸,所以硝酸酸性较强,硝酸根离子中孤店子对个数=

故答案为HNO3 NO3— V形
考查方向
解题思路
同主族元素,元素第一电离能随着原子序数增大而减小;
同一非金属元素形成的含氧酸中,非羟基O原子个数越多该酸酸性越强,硝酸分子中非羟基氧原子个数大于亚硝酸,所以硝酸酸性较强,硝酸根离子中孤店子对个数=

易错点
第一电离能变化规律未掌握
不会通过计算发法推断出空间构型
正确答案
氮化硼(或BN) 5.8×1032/NA·a3
解析
立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径小,共价键越强,晶体熔点越高,故氮化硼熔点更高;晶胞中 As、Ga原子数目均为4,晶胞质量为
故答案为:5.8×1032/NA·a3
考查方向
解题思路
立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径小,共价键越强,晶体熔点越高,根据均摊法计算晶胞中As、Ga原子数目,表示出晶胞质量,根据密度共识进行计算
易错点
不会利用密度公式进行晶胞的基本计算
扫码查看完整答案与解析