- 键能、键长、键角及其应用
- 共10题
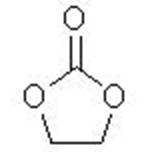
7.碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如下图。下列有关该物质的说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是_________。
a. N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量
b. P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c. 基态As原子中,电子占据的最高能级为4d
d. Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是_________。向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有_________和_________。
(3)PC13分子中,Cl—P—Cl键的键角_________109°28′(填“>”“<”或“=”)。
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。己知该晶体的密度为pg·cm-3,晶胞的边长为acm,则阿伏加德罗常数为_________mol-1(用含p、a的式子表示)。
正确答案
(1)b
(2)NH3分子与水分子之间能够形成氢键;离子键;配位键
(3)<
(4)496/(ρa3)
解析
略。
知识点
关于键长、键能和键角的说法中不正确的是
正确答案
解析
略
知识点
PH3一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是
正确答案
解析
本题考查化学键、分子构型。意在考查考生分子结构的知识。PH3同NH3构型相同,因中心原子上有一对孤电子对,均为三角锥形,属于极性分子,故A、B项正确;PH3的沸点NH3,是因为NH3分子间存在氢键,C项错误;PH3的稳定性低于NH3,是因为N-H键键能高,D项正确。
知识点
已知:P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ∙mol—1,P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ∙mol—1,P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ∙mol—1,PCl3中P-Cl键的键能为1.2c kJ∙mol—1。下列叙述正确的是
正确答案
解析
原子半径P>Cl,因此P-P键键长大于P-Cl键键长,则P-P键键能小于P-Cl键键能,A项错误;利用“盖斯定律”,结合题中给出两个热化学方程式可求出Cl2(g)+PCl3(g)=PCl5(g)△H=(b-a)/4KJ·mol-1,但不知PCl5(g)=PCl5(s)的△H,因此无法求出Cl2(g)+PCl3(g)=PCl5(s)的△H,B项错误;利用Cl2(g)+PCl3(g)=PCl5(g)△H=(b-a)/4KJ·mol-1可得E(Cl-Cl)+3×1.2c-5c=(b-a)/4,因此可得E(Cl-Cl)=(b-a+5.6c)/4kJ·mol-1,C项正确;由P4是正四面体可知P4中含有6个P-P键,由题意得6E(P-P)+10×(b-a+5.6c)/4-4×5c=b,解得E(P-P)=(2.5a-1.5b+6c)/6 kJ·mol-1,D项错误。
知识点
扫码查看完整答案与解析