- 元素质量分数的计算
- 共33题
23.四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
(1)Z在元素周期表中位于( ) 族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其它三种物质发生化学反应,该元素是( ) (填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是( ) (填序号)。
a.自然界中的含量 b.相应氯化物水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
②W、X、Y、Z的离子半径由大到小的顺序为( ) 。(填对应的离子符号)
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是 ( ) ,混合后溶液中离子浓度由大到小的顺序是 ( ) 。
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。
能确定混合物中Y的质量分数的数据有( ) (填序号)。
a.m、n b.m、y c.n、y
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
24.(14分)
锗(Ge)产品加工废料可用于生产降解农药废水的纳米GeO2催化剂,工业流程如下图。
(1)操作X为( )。
(2)Y溶液是一种在该流程中可循环利用的物质,该物质是( )(填化学式)。
(3)②中Ge2+生成Ge4+的离子方程式为( ) 。
(4)已知25℃时,

(5)若要将Fe(OH)3和Al(OH)3分离回收,需要用到的试剂有( )(填化学式)。
(6)该锗产品加工废料中含锗的质量分数不少于____。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
(1)实验过程中,使用分液漏斗滴加液体的操作是( ) 。
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行,原因是 ( )。
(3)实验Ⅲ烧瓶中发生反应的化学方程式是 ( ),打开开关K,产生的气体经验纯后点燃,现象是 ( ) 。
(4)实验Ⅱ中量气管中的液体最好是____(填字母编号,下同)
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有( )
(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温②( ),③视线与凹液面最低处相平。
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
根据上述数据,可计算出镁铝合金中铝的质量分数为____ 。(保留一位小数)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去)。称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解。实验前量气管起始读数为amL,实验后量气管的最终读数为bmL。
请回答下列问题;
(1)按上图完成装置连接,开始实验前必须进行的操作是 _______ 。
(2)写出锥形瓶中发生化合反应的离子方程式:_________。
(3)实验结束后,锥形瓶内溶液中存在的金属离子有哪些可能?请根据选项进行填空(表格不一定填完):
A.盐酸
B.KSCN溶液
C.酸性KMnO4溶液
D.H2O2溶液
(4)实验中要对量气管多次读数,读数时应注意:①将实验装置恢复到室温;②_________; ③视线与凹液面最低处相平。若读取量气管中气体的体积时,液面左高右低,则所测气体的体积_________ (填“偏大”、“偏小”或“无影响’’)。
(5)若样品与足量稀硫酸反应后滴入KSCN溶液不显红色且量气管读数b>a(该实 验条件下的气体摩尔体积为Vm)。下列有关单质铁质量分数的计算过程是否正确 ____ (填“是”或“否”)?理由是 ________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
24.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下:
(1)在“还原焙烧”中产生的有毒气体可能有( )。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示:( ) 。
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于( ),当pH=5时,溶液中c(Al3+)为( )mol·L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33)。
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为 ( ) 。
若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是( )。
(5)A的操作是 ( ) 。
(6)m g烧渣经过上述工艺可得红氧化铁n g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于( )(用含m、n的表达式表示)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.将一定量甘油[C3H5(OH)3]溶于甲苯中(
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
25.现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
Ⅰ 探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为________。
未点燃酒精灯前,A、B均无明显现象,其原因是:_____。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式_____________________________________(任写一个)。B中的现象是______________,由此可得到浓硫酸具有____________性。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式___________(任写一个)。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________________________。
Ⅱ 测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。
铁碳合金中铁的质量分数为_____________________(写表达式)。
(7)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是___________ (填写代号)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
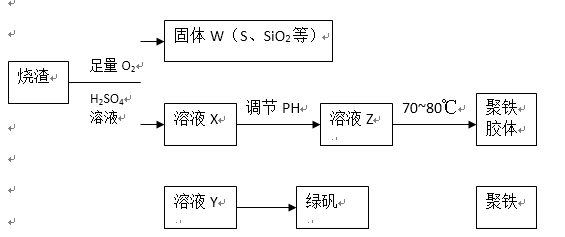
24.实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS.SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是( );
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2.H2SO4反应的化学方程式为:( );
(3)过程③中,需加入的物质是( );
(4)过程④中,蒸发结晶需要使用酒精灯.三角架.泥三角,还需要的仪器有
( );
(5)过程⑤调节pH可选用下列试剂中的( ) (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是( );
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.700g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤.洗涤.干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 ( ) 。(假设杂质中不含铁元素和硫元素)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.(14分)聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m, 广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
(1)验证固体W焙烧后产生的气体含有SO2的方法是:________________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→____→____→____→____→f。
装置A中发生反应的化学方程式为_________________________________________。
(3)制备绿矾时,向溶液X中加入过量__________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有_____________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数______(填“偏大”、“偏小”或“无影响”
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.聚合硫酸铁又称聚铁,化学式为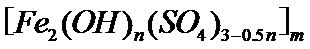
(1)验证固体W焙烧后产生的气体含有SO2 的方法是_▲__。
(2)制备绿矾时,向溶液X中加入过量__▲_,充分反应后,经__▲___操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(3)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为__▲__。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏__▲___。
(4)古代将绿矾煅烧可制绿矾油(也叫镪水,即硫酸)和红色颜料(Fe2O3),请写出有关的化学方程式:( ▲ )。
(5)绿矾还可用以下方法生产红色颜料(Fe2O3),其具体操作流程是:将5560kg绿矾(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入16680 kg 绿矾和560 kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_________▲___________kg。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析