- 氧族与碳族及其应用
- 共249题
14.25℃时,下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.如下图,在25℃,101.3KPa下,将10mLO2全部压入左端盛有20mLN0的注射器中充分反应。以下对压入O2后左端注射器中的气体描述错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
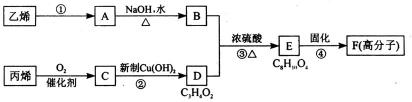
17.以石化产品乙烯、丙烯为原料合成厌氧胶的流程如下。
关于该过程的相关叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
25.Ⅰ.向FeCl3溶液中加入铁粉和铜粉混合粉末,充分反应后,下列情况可能存在的是 (填序号)
Ⅱ.今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3,溶液(其他用品略),某课外活动小组同学的实验结果如下(假定反应前后溶液体积不变)。
(1)试判断第④组剩余固体质量x为___________。第①组实验中,发生反应的离子方程式为 _____________________。
(2)试判断第②组剩余固体的成分为_________________。
(3)原混合粉末中Fe.Cu的物质的量之比为____________________。
正确答案
Ⅰ. ②③⑥⑦
Ⅱ.
(1) 0 2Fe3++ Fe=3Fe2+
(2) Cu
(3) 6﹕1
解析
解析已在路上飞奔,马上就到!
知识点
硫在自然界中以游离态和多种化合态形成出现。硫的化合物大多具有氧化性或还原性。许多金属硫化物难溶于水。
完成下列填空:
(1)硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式。_________________________________
(2)石油化工的废气中有H2S。写出从废气中回收单质硫的两种方法(除空气外,不使用其他原料),以化学方程式表示。_____________________、______________________
(3)室温下,0.1mol/L的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是_______,其原因是________。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
(4)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象。__________________________
(5)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有____、______。过滤,微热滤液,然后加入过量的氢氧化钠溶液,可观察到的现象是______________。
正确答案
答案:(1)3H2SO4+5H2S+2KMnO4→5S↓+2Mn SO4+K2 SO4+8H2O
(2)2H2S+3O2
2SO2+2 H2O, 2H2S+SO2→3S+2 H2O;H2S
S+H2或2 H2S+ O2
2S+2 H2O
(3)硫化钠溶液;硫化氢的Ki2小于碳酸的Ki2,硫化钠更易水解。
(4)饱和H2S溶液中电离产生的S2-很少,因此没有沉淀。加入氨水后,促进H2S电离,S2-离子浓度增大,有沉淀产生。
(5)FeCl2 、H2S ;先有白色沉淀生成,然后沉淀转化为灰绿色,最终转化为红褐色。
解析
略
知识点
硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。
完成下列计算:
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为________mol/。
(2)若以浓硫酸吸水后生成的H2SO4·H2O计算,250g质量分数为98%的硫酸能吸收多少g水?
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2 4FeS2+11 O2→2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比。
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。
硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体)。(已知空气组成:N2体积分数0.79、O2体积分数0.21)
正确答案
答案: (1) 1.25
(2) 250×98%÷98×14=40g
(3) 2934.4÷22.4=131mol 设Fe3O4 amol Fe2O3 bmol
3a+2b=48 8a+11÷2b=131 a=4 b=18
n(Fe3O4):n(Fe2O3)=2:9
(4)设混合气体为1体积,0.84体积硫化氢完全燃烧生成0.84体积二氧化硫和0.84体积水,消耗1.26体积氧气。
所需空气为1.26÷0.21×1.77=10.62体积
φ(SO2)=0.84÷(10.62-1.26+1.84)=0.075
解析
略
知识点
和氢硫酸反应不能产生沉淀的是
正确答案
解析
本题考查元素化合物知识,意在考查考生对化学反应的知识掌握的再现能力。A项能生成PbSO4沉淀;C项生成CuS沉淀;D项因发生氧化还原反应生成单质硫沉淀,故正确答案为:B。
知识点
水是生命之源,万物之基,是人类最宝贵的自然资源
(1)我国规定水质各种指标的主要要求为:a.不得呈现异色:b.不得有异味:C.水应澄清透明:d,不得含有细菌和病毒。前两项指标可以利用活性炭的____作用来实现:后两项指标可以通过加入消毒剂、絮凝剂反应、沉降,然后通过_____(填操作名称)来实现
(2)我国规定饮用水的硬度不超过25度硬度的表示方法是:将水中的



(3)某地下水的硬度是由Ca(HC03)2所引起的,下列方法中能够使之软化的是_____
正确答案
解析
略
知识点
下列与生活相关的叙述错误的是
正确答案
解析
略。
知识点
将通有H2S的导气管伸入充满氧气的集气瓶内点燃,描述反应过程的曲线错误的是()
正确答案
解析
略
知识点
扫码查看完整答案与解析