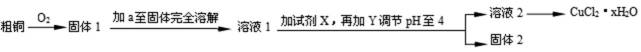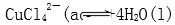- 金属及其化合物
- 共561题
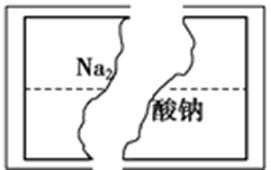
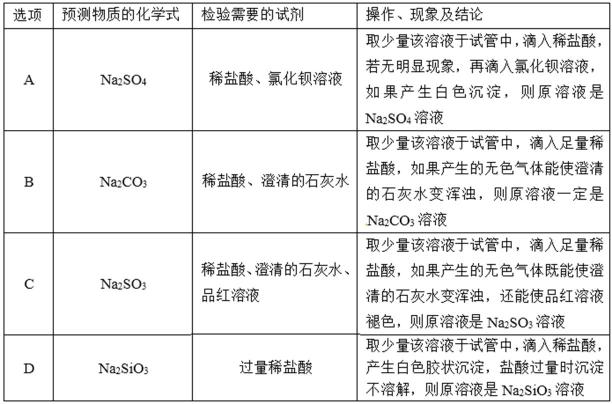
6.某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论) ()
正确答案
解析
A.取少量该溶液于试管中,滴入稀盐酸,盐酸可排除其它离子的干扰,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,沉淀为硫酸钡,则原溶液是Na2SO4溶液,故A正确;
B.取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,无色气体时澄清石灰水变浑浊,气体可能为二氧化碳,或二氧化硫,则溶液可能为Na2CO3溶液,故B错误;
C.取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则气体为二氧化硫,所以则原溶液是Na2SO3溶液,故C正确;
D.取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,硅酸不溶于盐酸,则原溶液是Na2SiO3溶液,故D正确。
考查方向
解题思路
A.盐酸可排除其它离子的干扰,再滴加氯化钡产生白色沉淀,则沉淀为硫酸钡;
B.无色气体时澄清石灰水变浑浊,气体可能为二氧化碳,或二氧化硫;
C.无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则气体为二氧化硫;
D.硅酸不溶于盐酸.
易错点
离子的检验及气体的检验。
知识点
氯化铜用作陶瓷着色剂、玻璃、电镀添加剂、催化剂、照相制版及饲料添加剂等。某学习小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
已知氯化铜易溶于水,难溶于乙醇。
13.溶液1中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液1中Fe2+的试剂 (填编号)
①KMnO4
②K3[Fe(CN)6]
③NaOH
④KSCN
为了更完全的沉淀,试剂X为 。
14.试剂a是 ,加入需过量的原因是 。试剂Y用于调节pH以除去杂质,Y可选用下列试剂中的 (填序号)。
a.NaOH
b.NH3·H2O
c.CuO
d.Cu2(OH) 2CO3
e.CuSO4
调节pH至4的原因是 。
得到固体2的操作是 。
15.在溶液2转化为CuCl2·xH2O的操作过程中,发现溶液颜色由蓝色变为绿色。欲探究其原因。已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq)
蓝色 黄色
①上述反应的化学平衡常数表达式是K= 。若增大氯离子浓度,K值 (填“增大”、“减小”或“不变”)
16.② 取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是 (填序号)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
17.得到CuCl2·xH2O晶体最好采用的干燥方式是 。
18.为测定制得的氯化铜晶体(CuCl2·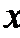
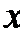
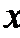
正确答案
② H2O2溶液
解析
由图示可知:粗铜和氧气反应生成氧化铜、四氧化三铁,加入稀盐酸至固体完全溶解,为了防止氯化铜等物质发生水解,加入过量稀盐酸得溶液1,再加入过氧化氢溶液将部分可能存在的亚铁离子氧化成三价铁离子,再加入碱式碳酸铜调节溶液的酸碱度至pH在4,使三价铁离子生成氢氧化铁除去,过滤可得固体2氢氧化铁和溶液2氯化铜溶液,蒸发结晶得氯化铜晶体(CuCl2·2H2O)。
铁氰酸钾(铁氰化钾),不和Fe3+、Cu2+反应,和Fe2+反应得到一种蓝色的沉淀,溶液1中的金属离子有Fe3+、Fe2+、Cu2+,能检验溶液1中Fe2+的试剂是②K3[Fe(CN)6],故选②;
为了更完全的沉淀,将铁离子和亚铁离子完全除去,应先将亚铁离子氧化成铁离子,同时又不带入杂质离子,试剂X为H2O2溶液;
考查方向
解题思路
由图示可知:粗铜和氧气反应生成氧化铜、四氧化三铁,加入稀盐酸至固体完全溶解,为了防止氯化铜等物质发生水解,加入过量稀盐酸得溶液1,再加入过氧化氢溶液将部分可能存在的亚铁离子氧化成三价铁离子,再加入碱式碳酸铜调节溶液的酸碱度至pH在4,使三价铁离子生成氢氧化铁除去,过滤可得固体2氢氧化铁和溶液2氯化铜溶液,蒸发结晶得氯化铜晶体(CuCl2·2H2O)。
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
正确答案
稀盐酸 盐酸充分反应,且能抑制Cu2+水解 cd;
为了使Fe3+完全沉淀而Cu2+不沉淀,可以调节pH至4 过滤
解析
将氧化铜、四氧化三铁溶解,应加入稀盐酸至固体完全溶解,试剂a是稀盐酸,加入需过量的原因是盐酸充分反应,且能抑制Cu2+水解。试剂Y用于调节pH以除去杂质铁离子,应该可以将酸碱度升高,而且不会带入杂质离子,Y可选用CuO 或Cu2(OH) 2CO3,故选cd;
因为pH=3时,Fe3+完全沉淀而Cu2+不沉淀,为了使Fe3+完全沉淀而Cu2+不沉淀,可以调节pH至4;
利用过滤将固液混合物分离,得到固体2和溶液2;
考查方向
解题思路
(2) 将氧化铜、四氧化三铁溶解,应加入稀盐酸至固体完全溶解,加入需过量的原因是盐酸充分反应,且能抑制Cu2+水解。调节pH以除去杂质铁离子,应该可以将酸碱度升高,而且不会带入杂质离子,可选用CuO 或Cu2(OH) 2CO3;pH=3时,Fe3+完全沉淀而Cu2+不沉淀;
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
正确答案
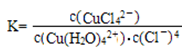
解析
在溶液2转化为CuCl2·xH2O的操作过程中,发现溶液颜色由蓝色变为绿色。在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq) CuCl42-(aq)
蓝色 黄色
上述反应的化学平衡常数表达式是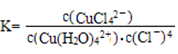
考查方向
制备实验方案的设计
解题思路
化学平衡常数表达式是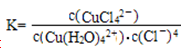
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
正确答案
abc
解析
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是:
a.将Y稀释,平衡向逆反应方向移动,溶液呈蓝色,正确;
b.在Y中加入CuCl2晶体,氯离子浓度增大,平衡向正反应方向移动,溶液变为绿色,正确;
c.在Y中加入NaCl固体,氯离子浓度增大,平衡向正反应方向移动,溶液变为绿色,正确;
d.取Y进行电解,氯离子失去电子,生成氯气,铜离子得到电子,生成金属铜,溶液颜色最终消失,与平衡移动无关,错误;
故选abc;
考查方向
解题思路
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是:
a.将Y稀释,平衡向逆反应方向移动,溶液呈蓝色;
b.在Y中加入CuCl2晶体,氯离子浓度增大,平衡向正反应方向移动,溶液变为绿色;
c.在Y中加入NaCl固体,氯离子浓度增大,平衡向正反应方向移动,溶液变为绿色;
d.取Y进行电解,氯离子失去电子,生成氯气,铜离子得到电子,生成金属铜,溶液颜色最终消失,与平衡移动无关;
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
正确答案
解析
CuCl2•xH2O晶体加热容易分解,且氯化铜易水解,应在HCl气流中低温烘干,故选D。
考查方向
解题思路
CuCl2•xH2O晶体加热容易分解,且氯化铜易水解,应在HCl气流中低温烘干。
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
正确答案

解析
氢氧化铜加热分解所得黑色固体的质量ng为CuO,根据Cu元素守恒:n(CuCl2•xH2O)=n(CuO)=
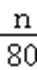

考查方向
解题思路
氢氧化铜加热分解所得黑色固体的质量ng为CuO,根据Cu元素守恒计算;
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
9. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
正确答案
D
解析
A.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液可能是碳酸盐溶液、碳酸氢盐溶液或亚硫酸盐溶液,错误;
B.向盛有2mL 0.5mol/LNaOH溶液的试管中滴加2滴0.2mol/L的MgCl2溶液出现白色沉淀,继续滴加0.2mol/L FeCl3溶液,有红褐色沉淀产生,因为氢氧化钠过量,不能说明Ksp[Mg(OH)2]>Ksp[Fe(OH)3],错误;
C.因为玻璃棒成分中有硅酸钠,也会发生焰色反应,正确做法是用铂丝蘸取,错误;
D.将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置,下层溶液显紫红色,说明碘离子被氧化成单质碘,因此氧化性:Fe3+>I2,正确。故选D。
考查方向
解题思路
A.使澄清石灰水变浑浊,该溶液可能是碳酸盐溶液、碳酸氢盐溶液或亚硫酸盐溶液;
B.因为氢氧化钠过量,不能说明Ksp[Mg(OH)2]>Ksp[Fe(OH)3];
C.因为玻璃棒成分中有硅酸钠,也会发生焰色反应;
D.将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置,下层溶液显紫红色,说明碘离子被氧化成单质碘。
易错点
本题考查物质的检验和鉴别,为高频考点,侧重常见离子检验的考查,明确检验时试剂、现象及结论的关系,注意排除其他干扰离子为解答的易错点,题目难度不大。
知识点
1.明代《天工开物》记载“火法”冶炼锌:
正确答案
解析
碳酸锌与碳在高温下反应生成锌和一氧化碳,反应的方程式为ZnCO3+2C
A.由题意可知,倭铅是指金属锌,A错误.
B.反应中C作还原剂,则煤炭中起作用的主要成分是C,B正确;
C.冶炼Zn的反应方程式为:ZnCO3+2C
D.该冶炼锌的反应属于置换反应,D正确。
故选A。
考查方向
解题思路
碳酸锌与碳在高温下反应生成锌和一氧化碳,反应的方程式为ZnCO3+2C
易错点
本题以锌的冶炼为知识背景,考查了置换反应、方程式的书写、题目信息的应用等,题目难度中等,侧重于考查学生的阅读能力和对信息的应用能力。
知识点
8.MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:
回答下列问题:
(1)操作Ⅰ为: 。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:________________________________
(3) 调节溶液pH所用物质X最好为( )A. NaOH溶液 B. 氨水 C. MnCO3固体 D. 盐酸
(4)滤渣Ⅰ为__________,滤渣Ⅱ为__________。
(5)沉锰的化学方程式为:____________________。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:____________________。
正确答案
(1)过滤
(2)FeS + 12H+ +3MnO2
(3)C
(4) Al(OH)3、Fe(OH)3 CaF2
(5) MnSO4 + 2NaHCO3=MnCO3 + Na2SO4 + H2O + CO2↑
(6)LiMn2O4 -xe- =Li1-xMn2O4 + xLi+
解析
(1)操作1得到的是S单质的沉淀,所以此处物质分离的方法是过滤。
(2)取溶液1加入KSCN溶液,溶液呈现出血红色,说明有三价铁离子的存在,所以在酸容的过程中FeS发生的离子方程式FeS + 12H+ +3MnO2
(3)由于不能引入杂质,则调节溶液的PH所用的物质X最好是MnCO3固体,答案选C。
(4)根据表中数据分析可得到当PH=6的时候,铁离子和氯离子会完全沉淀,因此滤渣是Al(OH)3、Fe(OH)3 ;滤液中还会含有钙离子,则加NaF后转换成Ca F2的沉淀。
(5)沉锰的化学物为NaHCO3 、MnSO4 ,化学方程式为:MnSO4 + 2NaHCO3=MnCO3 + Na2SO4 + H2O + CO2↑
(6)MnCO3也是制造锂离子电池的重要原料,在此电池充电过程中正极发生LiMn2O4失去电子的氧化反应, LiMn2O4 -xe- =Li1-xMn2O4 + xLi+
考查方向
解题思路
1、化工流程中的实验分析化工流程的命题来源很广,与各个知识模块的结合点较多,因此分析工业生产化工流程题时,应将流程路线、试题设问和理论知识有机结合起来,它常常结合工艺流程考查基本化学实验问题,可以说它是无机框图题的创新。流程的呈现形式有:①操作流程;②物质变化流程;③装置流程。
制备装置的识图技巧①明确目的;②所制备物质是否有特殊性质(即是否需要特殊保护);③制备过程中是否产生有毒气体等;④进入每一装置的物质是什么,吸收了什么物质或生成了什么物质。
2、解题时首先要明确原料和产品(包括副产品),即箭头进出方向,其次依据流程图分析反应原理,紧扣信息,搞清流程中每一步发生了什么反应——知其然,弄清有关反应原理,明确目的(如沉淀反应、除杂、分离)——知其所以然,最后联系储存的知识,有效地进行信息的利用,准确表述和工整书写。由于化工流程常与溶液的配制、物质的分离及定量测定等基本操作有机结合起来,所以只有复习时牢固掌握实验基础知识,才能有效结合题中的信息,准确答题。
易错点
1、表中数据分析可得到当PH=6的时候,铁离子和氯离子会完全沉淀。
2、电池充电过程中正极发生LiMn2O4失去电子的氧化反应的书写。
知识点
9.碳酸镍可用于电镀、陶瓷器着色等。镍矿渣中镍元素的主要存在形式是Ni(OH)2和NiS(含有Fe、Cu、Ca、Mg、Zn等元素杂质),从镍矿渣出发制备碳酸镍的流程如下:
已知:常温下,溶度积常数

②NiS + ClO3- + H+ — Ni2+ + S + Cl- + H2O(未配平),此反应中还原产物与氧化产物的物质的量比为____________。
(2)经实验检验,含Ni2+浸出液中铁元素的存在形式只有Fe3+,证明该溶液中无Fe2+可选用的试剂是____________________,现象为______________________________。
(3)加入Na2CO3溶液沉铁时生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6]和一种无色气体。写出此反应的离子方程式:__________________________________________________。
(4)加入NiS的作用是除去溶液中的Cu2+,原理是NiS(s) + Cu2+(aq)
(5)加入NaF的作用是______________________________。
(6)加入Na2CO3溶液沉镍,检验Ni2+是否沉淀完全的方法是____________________。
正确答案
(1)Ni(OH)2 + 2H+ = Ni2+ + 2H2O 1:3
(2)少量KMnO4溶液或K3[Fe(CN)6]溶液);KMnO4溶液紫色未褪或未产生蓝色沉淀
(3)Na+ + 3Fe3+ + 2SO42–+ 3H2O + 3CO32– = NaFe3(SO4)2(OH)6 ↓+ 3CO2↑
(4)1.27×10–16
(5)除去溶液中的Ca2+、Mg2+
(6)静置后取上层清液少许于试管中,滴加Na2CO3溶液,若未出现浑浊,则沉淀完全
解析
(1)由于镍矿渣中镍元素的存在形式Ni(OH)2,所以发生反应的离子方程式为:Ni(OH)2 + 2H+ = Ni2+ + 2H2O,由于还原产物Cl-化合价降低了6,氧化产物S的化合价升高了2,所以根据化合价的公倍数确定物质的量比为2:6=1:3;
(2)要证明Fe3+溶液中无Fe2+,可选用少量酸性KMnO4溶液,Fe2+可使酸性KMnO4溶液褪色,或可选用K3[Fe(CN)6]溶液,Fe2+与K3[Fe(CN)6]溶液反应有蓝色沉淀产生;
(3)Na2CO3溶液沉铁时生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6]和一种无色气体,根据元素守恒可知气体为CO2,所以发生反应的离子方程式为:Na+ + 3Fe3++ 2SO42–+ 3H2O + 3CO32–= NaFe3(SO4)2(OH)6 ↓+ 3CO2↑
(4)根据反应NiS(s) + Cu2+(aq)CuS(s) + Ni2+(aq)可知,
K=Ksp(NiS)/Ksp(CuS)=c(Ni2+) /c(Cu2+)=(1.07 × 10-21)/(1.27 × 10-36)=1.27×10–16
(5)由于滤液3中无Ca2+、Mg2+离子,所以根据元素守恒可知加入NaF的作用是除去溶液中的Ca2+、Mg2+;
(6)由于NiCO3溶液为沉淀,所以用Na2CO3溶液检验Ni2+是否沉淀,即静置后取上层清液少许于试管中,滴加Na2CO3溶液,若未出现浑浊,则沉淀完全。
考查方向
解题思路
(1)根据镍矿渣中镍元素的存在形式Ni(OH)2进行分析,完成方程式,还原产物与氧化产物的物质的量比可以根据化合价的公倍数确定;
(2)证明Fe3+溶液中无Fe2+可选用的试剂少量KMnO4溶液(褪色)或K3[Fe(CN)6]溶液(蓝色沉淀)
(3)Na2CO3溶液沉铁时生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6]和一种无色气体,根据元素守恒可知气体为CO2
(4)根据反应NiS(s) + Cu2+(aq)
(5)根据元素守恒可知滤液3中无Ca2+、Mg2+离子,所以加入NaF的作用是除去溶液中的Ca2+、Mg2+;
(6)由于NiCO3溶液为沉淀,所以用Na2CO3溶液检验Ni2+是否沉淀。
易错点
不能有效提取图表中信息,阅读材料、接受信息的能力不强,物质的分离提纯的方法掌握不熟练,不能通过化合价升价确立生成物的比值,不能根据原子守恒确立反应方程式以及分析物质的作用。
知识点
合金是建造航空母舰的主体材料。如:航母舰体可由合金钢制造,航母升降机可由铝合金制造;航母螺旋桨主要用铜合金制造。
(1)Al原子核外电子占据 个纺锤形轨道;Fe原子核外电子排布式为
(2)下列事实可用作比较Al和Fe金属性强弱依据的是 ( )
A,Al的导电性、导热性比Fe更好
B,

C,相同质量的Al片和Fe片,投入到等浓度的稀硫酸溶液中,Al片产生氢气更多
D,在野外利用铝热剂焊接铁轨
(3),航母在海洋中行驶时,舰体发生的电化学腐蚀类型为: ,其中正极发生的电极反应式为: 。
(4)取a克CuAl合金样品用酸完全溶解后,加入过量NaOH,过滤、洗涤、烘干、灼烧得a克固体,则合金中Cu的质量分数为 。
(5)AlMg合金焊接前用NaOH溶液处理铝表面Al2O3膜,其化学方程式为: 。
(6)取适量AlMg合金样品置于烧杯中,加入20mL 1 mol/L的NaOH溶液,恰好完全反应。
下列叙述正确的是 ( )
A,Mg作负极,Al作正极
B,该反应速率比纯铝与NaOH溶液的反应速率快
C,若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为
D,若加入的是20mL 1 mol/L的盐酸,则放出的氢气的物质的量减少
正确答案
(1) 4 , 7种
(2)D
(3)吸氧腐蚀 , O2 +2H2O+4e →4OH―
(4)0.80
(5) Al2O3 + 2NaOH → 2NaAlO2 +H2O
(6)BD
解析
略
知识点
将铜丝烧热,迅速插入氢气中,发生反应:
正确答案
解析
略
知识点
有4种金属a、b、c、d,它们与浓HNO3反应时,只有a不反应;往这4种金属粉末的混合物中加入盐酸,其中b、c溶解,过滤后,在滤液中加入过量的NaOH溶液,可得到c离子的沉淀,则这4种金属的活动性强弱的顺序可能是
正确答案
解析
略
知识点
有关下列物质说法正确的是( )
正确答案
解析
略
知识点
扫码查看完整答案与解析