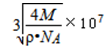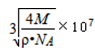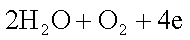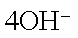- 氧族与碳族及其应用
- 共249题
12.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。回答下列问题:
(1)基态砷原子的电子排布式为 .
(2)K3[Fe(CN)6]晶体中Fe3+与CN之间化学键类型为

(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、O3、CH2=CHCHO、HCOOH、CH3—C—0—0—N02 (PAN)等二次污染物。
①N20结构式可表示为N = N = 0,N20中中心氮原子的杂化轨道类型为 ,1 mol PAN中含σ键数目为 。
②测定大气中PM2.5的浓度方法之一是
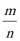
正确答案
(1)1s22s22p63s23p63d104s24p3;
(2)配位键;CO;
(3)sp 10NA
(4)3
解析
(1)As的原子序数为33,基态原子的电子排布式为1s22s22p63s23p63d104s24p3,故答案为:1s22s22p63s23p63d104s24p3;
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-能提供孤对电子,所以能形成配位键。原子数相同、电子数也相同的物质称为等电子体,运用等量异质替换将,N原子电子数加1得O原子,可得CN-的等电子体为CO;故答案为:配位键、CO
(3)N20结构式可表示为N=N=0,N20中中心氮原子的价层电子对的数目为(5-1)/2=2。所以杂化方式为sp。一个单键就是一个σ键,一个双键含有一个σ键和一个π键;根据PAN的结构式: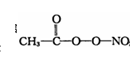
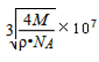
考查方向
解题思路
(1)As的原子序数为33,基态原子的电子排布式为1s22s22p63s23p63d104s24p3(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-能提供孤对电子,所以能形成配位键;原子数相同、电子数也相同的物质称为等电子体,运用等量异质替换将,N原子电子数加1得O原子,可得CN-的等电子体;
(3)N20结构式可表示为N = N = 0,根据N20中中心氮原子的价层电子对的数目判断杂化方式,一个单键就是一个σ键,一个双键含有一个σ键和一个π键;
(4)以顶点为为计算,与相邻的最近的Kr位于三个面上,而顶点的原子为8个立方体共有,每个面心的原子为2个立方体共有,故与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含有的Kr原子为8×(1/8)+6×(1/2)=4,然后求出比值,根据=m/V求得晶胞的体积,进而求出边长;
易错点
对物质结构知识把握不准确;由于不能有效掌握等电子体的实质与分析策略,所
以不能快速准确写出等电子体;空间想象能力薄弱,不能通过密度和参数a的关系进行准确
计算;不注意单位换算致错。
知识点
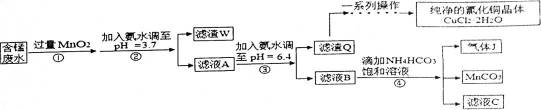
利用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)及纯净的氯化铀晶体(CuCl2·2H2O)。工业流程如下:
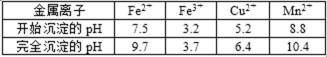
己知:几种金属离子沉淀的pH如表
回答下列问题:
13.过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式是 ▲ 。
14.过程②中,所得滤渣W的成分是 ▲ 。
15.(3)过程③中,调pH=6.4目的是 ▲ 。
16.过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3反应的离子方程式是 ▲ 。
17.将滤渣Q溶解在过量的盐酸中,经过 ▲ ,过滤、洗涤、低温烘干,即可获得纯净的氯化铜晶体(CuCl2·2H2O)。
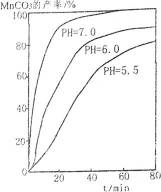
18.过程④中,298K、c(Mn2+)为1.05mol·L-1时,实验测得MnCO3的产率与溶液pH、反应时间关系如右图。据图中信息,你选择的最佳pH是 ▲ ;理由是 ▲ 。
19.从滤液C可得到的副产品是 ▲ (填化学式)。
正确答案
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
解析
过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
考查方向
解题思路
先要了解此化学流程中各个环节的目的,Mn2+、Cl-、H+、Fe2+、Cu2+中要保留下Mn2+、Cl-、H+,除掉Fe2+,过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,调节PH=3.7,的目的就是为了除掉Fe3+过程②中,所得滤渣W的成分切记不要忘了过量这个词,过程③中,调pH=6.4目的要根据图表发现是将Cu2+完全沉淀为Cu(OH)2,过程④中,若生成的气体J可使澄清石灰水变浑浊,则该气体是CO2,生成MnCO3反应的离子方程式中必有CO2,将滤渣Q是Cu(OH)2溶解在过量的盐酸中,得到的是CuCl2溶液,要得到晶体,需要考虑水解问题,过程④中,298K、c(Mn2+)为1.05mol·L-1时,实验测得MnCO3的产率与溶液pH、反应时间关系如右图。据图中信息,反应时间短,速率越快,滤液C可得到的副产品推断就看缺什么。
易错点
没有看明白在实验流程过程中的各个环节的目的推断的错误,不能正确写出化学反应方程式和离子方程式,在化学工艺流程中数据处理都会带来一定的失误,和根据所给的数据不能准确判断其反应原理
正确答案
Fe(OH)3和过量的MnO2
解析
过程②中,上面一步是将Fe2+转化为Fe3+ 在调节PH=3.7时,Fe3+会形成沉淀Fe(OH)3 ,但前面加入了过量的MnO2, 所得滤渣W的成分是Fe(OH)3和过量的MnO2。
考查方向
解题思路
先要了解此化学流程中各个环节的目的,Mn2+、Cl-、H+、Fe2+、Cu2+中要保留下Mn2+、Cl-、H+,除掉Fe2+,过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,调节PH=3.7,的目的就是为了除掉Fe3+过程②中,所得滤渣W的成分切记不要忘了过量这个词,过程③中,调pH=6.4目的要根据图表发现是将Cu2+完全沉淀为Cu(OH)2,过程④中,若生成的气体J可使澄清石灰水变浑浊,则该气体是CO2,生成MnCO3反应的离子方程式中必有CO2,将滤渣Q是Cu(OH)2溶解在过量的盐酸中,得到的是CuCl2溶液,要得到晶体,需要考虑水解问题,过程④中,298K、c(Mn2+)为1.05mol·L-1时,实验测得MnCO3的产率与溶液pH、反应时间关系如右图。据图中信息,反应时间短,速率越快,滤液C可得到的副产品推断就看缺什么。
易错点
没有看明白在实验流程过程中的各个环节的目的推断的错误,不能正确写出化学反应方程式和离子方程式,在化学工艺流程中数据处理都会带来一定的失误,和根据所给的数据不能准确判断其反应原理
正确答案
使Cu2+完全沉淀为Cu(OH)2
解析
过程③中,调pH=6.4由图表2中可知目的是使Cu2+完全沉淀为Cu(OH)2。
考查方向
解题思路
先要了解此化学流程中各个环节的目的,Mn2+、Cl-、H+、Fe2+、Cu2+中要保留下Mn2+、Cl-、H+,除掉Fe2+,过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,调节PH=3.7,的目的就是为了除掉Fe3+过程②中,所得滤渣W的成分切记不要忘了过量这个词,过程③中,调pH=6.4目的要根据图表发现是将Cu2+完全沉淀为Cu(OH)2,过程④中,若生成的气体J可使澄清石灰水变浑浊,则该气体是CO2,生成MnCO3反应的离子方程式中必有CO2,将滤渣Q是Cu(OH)2溶解在过量的盐酸中,得到的是CuCl2溶液,要得到晶体,需要考虑水解问题,过程④中,298K、c(Mn2+)为1.05mol·L-1时,实验测得MnCO3的产率与溶液pH、反应时间关系如右图。据图中信息,反应时间短,速率越快,滤液C可得到的副产品推断就看缺什么。
易错点
没有看明白在实验流程过程中的各个环节的目的推断的错误,不能正确写出化学反应方程式和离子方程式,在化学工艺流程中数据处理都会带来一定的失误,和根据所给的数据不能准确判断其反应原理
正确答案
n2+ +2HCO3-=MnCO3↓+ CO2↑+H2O
解析
过程④中,若生成的气体J可使澄清石灰水变浑浊,则J就是CO2,最后的产物中必有CO2,所以生成MnCO3反应的离子方程式是Mn2+ +2HCO3-=MnCO3↓+ CO2↑+H2O。
考查方向
解题思路
先要了解此化学流程中各个环节的目的,Mn2+、Cl-、H+、Fe2+、Cu2+中要保留下Mn2+、Cl-、H+,除掉Fe2+,过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,调节PH=3.7,的目的就是为了除掉Fe3+过程②中,所得滤渣W的成分切记不要忘了过量这个词,过程③中,调pH=6.4目的要根据图表发现是将Cu2+完全沉淀为Cu(OH)2,过程④中,若生成的气体J可使澄清石灰水变浑浊,则该气体是CO2,生成MnCO3反应的离子方程式中必有CO2,将滤渣Q是Cu(OH)2溶解在过量的盐酸中,得到的是CuCl2溶液,要得到晶体,需要考虑水解问题,过程④中,298K、c(Mn2+)为1.05mol·L-1时,实验测得MnCO3的产率与溶液pH、反应时间关系如右图。据图中信息,反应时间短,速率越快,滤液C可得到的副产品推断就看缺什么。
易错点
没有看明白在实验流程过程中的各个环节的目的推断的错误,不能正确写出化学反应方程式和离子方程式,在化学工艺流程中数据处理都会带来一定的失误,和根据所给的数据不能准确判断其反应原理
正确答案
加热浓缩,降温结晶(其它合理答案也给分)[
解析
将滤渣Q,Q为Cu(OH)2溶解在过量的盐酸中得到CuCl2溶液,想要获得纯净的氯化铜晶体(CuCl2·2H2O)则需要考虑盐的水解,如果是加热蒸发,最终得到的不是氯化铜晶体而是氢氧化铜,所以想得到氯化铜晶体先经过加热浓缩,降温结晶,过滤、洗涤、低温烘干即可。
考查方向
解题思路
先要了解此化学流程中各个环节的目的,Mn2+、Cl-、H+、Fe2+、Cu2+中要保留下Mn2+、Cl-、H+,除掉Fe2+,过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,调节PH=3.7,的目的就是为了除掉Fe3+过程②中,所得滤渣W的成分切记不要忘了过量这个词,过程③中,调pH=6.4目的要根据图表发现是将Cu2+完全沉淀为Cu(OH)2,过程④中,若生成的气体J可使澄清石灰水变浑浊,则该气体是CO2,生成MnCO3反应的离子方程式中必有CO2,将滤渣Q是Cu(OH)2溶解在过量的盐酸中,得到的是CuCl2溶液,要得到晶体,需要考虑水解问题,过程④中,298K、c(Mn2+)为1.05mol·L-1时,实验测得MnCO3的产率与溶液pH、反应时间关系如右图。据图中信息,反应时间短,速率越快,滤液C可得到的副产品推断就看缺什么。
易错点
没有看明白在实验流程过程中的各个环节的目的推断的错误,不能正确写出化学反应方程式和离子方程式,在化学工艺流程中数据处理都会带来一定的失误,和根据所给的数据不能准确判断其反应原理
正确答案
7.0 pH等于7.0时反应速率最快,且MnCO3产率最高
解析
过程④中,298K、c(Mn2+)为1.05mol·L-1时,实验测得MnCO3的产率与溶液pH、反应时间关系如右图。据图中信息,你选择的最佳pH是7;理由是反应时间短,速率越快。
考查方向
解题思路
先要了解此化学流程中各个环节的目的,Mn2+、Cl-、H+、Fe2+、Cu2+中要保留下Mn2+、Cl-、H+,除掉Fe2+,过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,调节PH=3.7,的目的就是为了除掉Fe3+过程②中,所得滤渣W的成分切记不要忘了过量这个词,过程③中,调pH=6.4目的要根据图表发现是将Cu2+完全沉淀为Cu(OH)2,过程④中,若生成的气体J可使澄清石灰水变浑浊,则该气体是CO2,生成MnCO3反应的离子方程式中必有CO2,将滤渣Q是Cu(OH)2溶解在过量的盐酸中,得到的是CuCl2溶液,要得到晶体,需要考虑水解问题,过程④中,298K、c(Mn2+)为1.05mol·L-1时,实验测得MnCO3的产率与溶液pH、反应时间关系如右图。据图中信息,反应时间短,速率越快,滤液C可得到的副产品推断就看缺什么。
易错点
没有看明白在实验流程过程中的各个环节的目的推断的错误,不能正确写出化学反应方程式和离子方程式,在化学工艺流程中数据处理都会带来一定的失误,和根据所给的数据不能准确判断其反应原理
正确答案
NH4Cl
解析
从滤液C可得到的副产品是NH4Cl
考查方向
解题思路
先要了解此化学流程中各个环节的目的,Mn2+、Cl-、H+、Fe2+、Cu2+中要保留下Mn2+、Cl-、H+,除掉Fe2+,过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,调节PH=3.7,的目的就是为了除掉Fe3+过程②中,所得滤渣W的成分切记不要忘了过量这个词,过程③中,调pH=6.4目的要根据图表发现是将Cu2+完全沉淀为Cu(OH)2,过程④中,若生成的气体J可使澄清石灰水变浑浊,则该气体是CO2,生成MnCO3反应的离子方程式中必有CO2,将滤渣Q是Cu(OH)2溶解在过量的盐酸中,得到的是CuCl2溶液,要得到晶体,需要考虑水解问题,过程④中,298K、c(Mn2+)为1.05mol·L-1时,实验测得MnCO3的产率与溶液pH、反应时间关系如右图。据图中信息,反应时间短,速率越快,滤液C可得到的副产品推断就看缺什么。
易错点
没有看明白在实验流程过程中的各个环节的目的推断的错误,不能正确写出化学反应方程式和离子方程式,在化学工艺流程中数据处理都会带来一定的失误,和根据所给的数据不能准确判断其反应原理
1.Si、SiO2广泛用于制造晶体管、光导纤维等。下列有关说法正确的是()
正确答案
解析
A、硅和二氧化硅与碱液都反应,所以碱液浸泡除去油污的同时又腐蚀了晶体,故A错误;B、二氧化硅能用于制光导纤维、二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水,所以形成光的断路,所以光导纤维遇碱会影响光信号传输,故B正确;C工业上用SiO2热还原法冶炼硅,而不是热分解法冶炼硅,故C错;D、但在自然界中仍以化合态形式存在,如二氧化硅、硅酸盐等,不是以游离态形式存在,故D错误;
考查方向
解题思路
A、硅和二氧化硅与碱液都反应;B、二氧化硅能用于制光导纤维、二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水,所以形成光的断路;C、工业上用SiO2热还原法冶炼硅;D、但在自然界中仍以化合态形式存在,如二氧化硅、硅酸盐等.
易错点
碳族元素.
知识点
【科目】化学
为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g) + O2(g) 
② C和C0的燃烧热(△H)分别为-393.5 kJ·mol-1和-283 kJ·mol-1
15.则2NO(g) + 2CO(g) 
17.烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表示)。
18.通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1 mol

正确答案
-746.5
解析
:①N2(g)+O2(g)═2NO(g)△H1=+180.5kJ•mol-1
②C的燃烧热(△H)为-393.5kJ•mol-1,热化学方程式为C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1;
③C0的燃烧热283kJ•mol-1 ,热化学方程式为CO(g)+0.5O2(g)=CO2(g)△H=-283kJ•mol-1;
依据盖斯定律计算③×2-①得到,2NO(g)+2CO(g)═N2(g)+2CO2(g)的△H=-746.5KJ/mol
故答案为:-746.5;
考查方向
解题思路
写出C和CO燃烧热的热化学方程式,结合盖斯定律计算所需要的热化学方程式;
易错点
热化学方程式书写方法,化学平衡建立,平衡状态影响因素分析,化学反应速率、平衡常数计算应用,电解质溶液电荷守恒,弱电解质电离平衡的计算应用
正确答案
2c(SO

解析
: 烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,依据溶液中电荷守恒分析,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),c(H+)=c(OH-),得到(Na+)=2c(SO32-)+c(HSO3-),故答案为:2c(SO32-)+c(HSO3-);
考查方向
解题思路
依据溶液中存在的电荷守恒分析;
易错点
热化学方程式书写方法,化学平衡建立,平衡状态影响因素分析,化学反应速率、平衡常数计算应用,电解质溶液电荷守恒,弱电解质电离平衡的计算应用
正确答案
1.0×10-7
解析
:常温下,0.1mol/L的HCOONa溶液pH为10,溶液中存在HCOO-水解HCOO-+H2O⇌HCOOH+OH-,故Kh=10−4×10−4/0.1−10−4=10-7,则HCOOH的电离常数Ka=Kw/Kh=10−14/10−7=1×10-7,故答案为:1.0×10-7
考查方向
解题思路
计算水解平衡常数Kh,再根据Ka=Kw/Kh计算.
易错点
热化学方程式书写方法,化学平衡建立,平衡状态影响因素分析,化学反应速率、平衡常数计算应用,电解质溶液电荷守恒,弱电解质电离平衡的计算应用
6.硅与某非金属元素X的化合物具有高熔点高硬度的性能,X一定不可能是( )
正确答案
解析
硅与某非金属元素X的化合物具有高熔点高硬度的性能,说明该晶体为原子晶体,可能为碳化硅,氮化硅,二氧化硅、而四氯化硅、四氟化硅为分子晶体,X一定不可能是ⅦA族元素,故选D
考查方向
元素周期律与元素周期表
解题思路
硅与某非金属元素X的化合物具有高熔点高硬度的性能,说明该晶体为原子晶体,可能为碳化硅,氮化硅,二氧化硅,以此来解答
易错点
能与硅形成的原子晶体的非金属元素找不全
教师点评
本题考查了原子晶体的性质,掌握常见的原子晶体是解题的关键
知识点
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
正确答案
解析
略
知识点
化学与环境、科学、技术密切相关。下列有关说法中正确的是
正确答案
解析
试题分析:A垃圾要分类处理,A错误;光导纤维是二氧化硅,是无机物,B错误;汽车尾气排出的NO、NO2等氮氧化物在光照条件下容易形成光化学污染物,C正确;合金的特点是熔点低、硬度大,D错误;故选C。
知识点
关于下图装置的叙述中正确的是
正确答案
解析
略
知识点
Fe2O3、ZnO、CuO的固体混合粉末
正确答案
解析
略
知识点
1.化学与社会、生活密切相关。对下列现象或事实的解释正确的是
正确答案
解析
A.化铝受热分解生成水,并吸收大量的热,是周围环境温度降低,且生成的氧化铝熔点高,附着在可燃物表面,从而阻止可燃物燃烧,故A错误
B. 二氧化硅是酸性氧化物,常温下能够与氢氟酸反应,故B错误
C. 过氧化钠与二氧化碳反应,生成碳酸钠和氧气,过氧化钠既作氧化剂又做还原剂,故C错误
D. 乙烯是一种植物生长调节剂,对水果蔬菜具有催熟的作用,乙烯含有不饱和键能被高锰酸钾氧化,故D正确。
故本题选D。
考查方向
解题思路
A.氢氧化铝受热分解生成水,并吸收大量的热,是周围环境温度降低
B.二氧化硅是酸性氧化物,常温下能够与氢氟酸反应
C.过氧化钠与二氧化碳反应,生成碳酸钠和氧气,过氧化钠既作氧化剂又做还原剂
D.乙烯是一种植物生长调节剂,对水果蔬菜具有催熟的作用
易错点
过氧化钠用于呼吸面具中作为氧气的来源,反应中过氧化钠既作氧化剂又做还原剂
知识点
扫码查看完整答案与解析