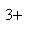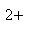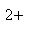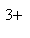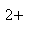- 铁盐和亚铁盐的相互转变
- 共25题
能正确表示下列反应的离子方程式是
正确答案
解析
A正确,符合3个守恒;B错误,电荷不守恒,Fe3O4中Fe有两种价态,正确应该为:Fe3O4+8H+=2Fe3++Fe2++4H2O;C错误,得失电子不守恒,电荷不守恒;正确的应为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;D错误,不符合客观实际,反应后铁只能产生Fe2+和H2;
知识点
工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主
要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为 。
(2)步骤③中,实现混合物的分离是利用物质的 (填字母序号)。
a. 熔沸点差异
b. 溶解性差异
c. 氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是 (填操作名称)。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:
。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰
(MnSO4,易溶于水),该反应的离子方程式为 。
(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极所发生反应的电极反应式: 。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释) 。
正确答案
见解析。
解析
(1)2Fe3+ + Fe === 3Fe2+
(2)b
(3)过滤
(4)溶液中存在平衡:TiO2+ + 2H2O 
平衡正向移动,生成H2TiO3。
(5)MnO2 + 2Fe2+ + 4H+ === Mn2+ + 2Fe3+ + 2H2O
(6)① 2O2- - 4e- == O2↑
或 C + 2O2- - 4e- == CO2↑
②制备TiO2时,在电解槽发生如下反应:
由此可见,CaO的量不变。
或: 制备TiO2时,在电解槽发生如下反应:
阴极:2Ca2+ + 4e- == 2Ca
阳极:2O2- - 4e- == O2↑
由此可见,CaO的量不变。
知识点
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为 :
(2)过程I 加入铁屑的主要作用是 ,分离得到固体的主要成分是 ,从固体中分离出铜需采用的方法是 ;
(3)过程II中发生反应的化学方程式为 ;
(4)过程II中调节溶液的pH为5,金属离子浓度为 。(列式计算)
正确答案
(1)2Fe3+ + Cu == 2Fe2+ + Cu2+;
(2)回收铜 Cu和Fe 加入过量的盐酸后过滤。
(3)FeCl2+Ca(OH)2==CaCl2+Fe(OH)2↓ 4Fe(OH)2+O2+2H2O===4Fe(OH)3
(4)4.0×10-11 mol·L-1
解析
(1) Fe3+具有强氧化性,能将Cu氧化,其离子方程式为2Fe3+ + Cu == 2Fe2+ + Cu2+;(2)废液中中含有Fe2+和Cu2+,加入过量的铁屑发生的反应为:Fe + Cu2+ = Fe2+ + Cu,故铁屑的作用是回收铜,分离得到的固体为Cu和Fe的混合物,从中得到铜的方法是先加入过量的盐酸,再过滤。
(3)“向滤液中加入一定量石灰水”发生的反应为:FeCl2+Ca(OH)2==CaCl2+Fe(OH)2↓;“鼓入足量的空气”发生的反应为:4Fe(OH)2+O2+2H2O===4Fe(OH)3。
(4)据KSP[Fe(OH)3]= c(Fe3+)·[c(OH-)]3 = 4.0×10-38 ,pH=5,c(OH-)=10-9mol·L-1,可知c(Fe3+)=4.0×10-11 mol·L-1。
知识点
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe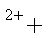
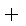
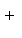
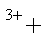
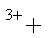
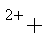
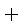
正确答案
解析
略
知识点
用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
正确答案
解析
略
知识点
扫码查看完整答案与解析