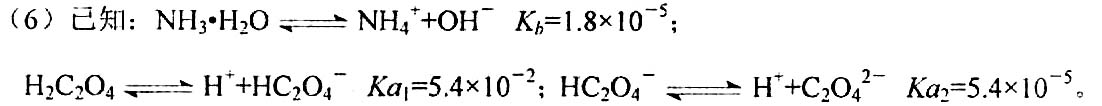- 铁盐和亚铁盐的相互转变
- 共25题
27.乙烯在不同的条件下可被氧化生成不同产物。如下图所示:
已知:取0.62g A与过量的金属钠完全作用后,生成224mL(标准状况)气体。B的沸点低(10.7℃),B不能发生银镜反应而C能。D有酸性、强氧化性,可用于消毒杀菌。
完成下列填空:
(1)写出结构简式。
A_______;D_______
(2)写出C发生银镜反应的化学方程式。
(3)在C的溶液中加入溴水实验现象:___________________________________。
解释产生该实验现象可能原因:___________________________________。
(4)D可以和乙烯反应产生B, 写出该反应的化学方程式。
正确答案
(1)A:
(2)CH3CHO+2[Ag(NH3)2]OH
(3)溴水褪色。乙醛具有还原性,被溴水氧化;溴与甲基上的氢原子进行取代;溴在不饱和键上发生加成反应。
(4)

解析
解析已在路上飞奔,马上就到!
知识点
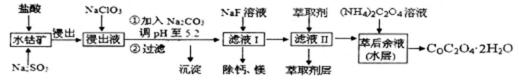
9.草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4·2H2O工艺流程如下:[
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是_______________。
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为______________________________________
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀。试用离子方程式和必要的文字简述其原理:_______________________________________________________
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液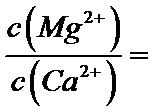
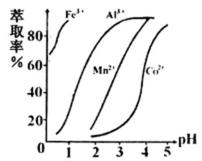
(5)萃取剂对金属离子的萃取率与pH的关系如右图所示,在滤液II中适宜萃取的pH为___左右。
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH_____7(填“>”或“<”或“=”)
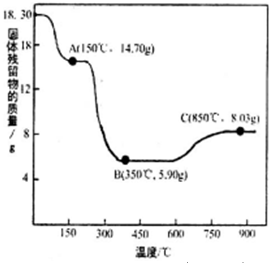
(7)CoC2O4·2H2O热分解质量变化过程如图所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是________________________________
正确答案
(1)还原Fe3+、Co3+为Fe2+、Co2+
(2)ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O
(3)加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用M3+代替)的水解平衡M3++3H2O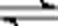
(4
(5)c
(6)<
(7)Co3O4
解析
(1)亚硫酸钠溶液具有还原性,在浸出过程中加入Na2SO3的目的是将Fe3+、Co3+ 还原为Fe2+、Co2+。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价-1价,则根据氧化还原反应得失电子守恒,该反应的离子方程式为ClO3- + 6Fe2+ + 6H+ = 6Fe3+ + Cl- + 3H2O
(3)加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:R3++3H2O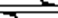
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,得到是MgF2、CaF2的过饱和溶液,根据溶液中氟离子的浓度相等,则所得滤液c(Mg2+)/ c (Ca2+)=Ksp(MgF2)/Ksp(CaF2)=7.35×10-11/1.05×10-10=0.7
(5)根据萃取剂对金属离子的萃取率与pH的关系。滤液Ⅱ中加入萃取剂的作用是除掉锰离子;使用萃取
剂适宜的pH是接近3.0,故选c;
(6)NH4+ 的水解平衡常数Kh=10-14/1.8×10-5 =5.55×10-10 ;C2O42-的水解平衡常数Kh=10-14/5.4×10-5 =1.85×10-10 ;因此该流程中所用(NH4)2C2O4溶液的pH<7;
(7)600℃以前A点是隔绝空气加热,CoC2O4·2H2O失去水分,质量减少了3.6g,生成0.1mol CoC2O4;
600℃以前B点是隔绝空气加热,质量减少了8.8g,0.1mol CoC2O4失去全部碳和氧元素,生成Co;
600℃以后是在空气中加热,C点质量增加2.13g,n(Co)=0.1mol,n(O)=0.133mol,所示产物的化学式是Co3O4。
考查方向
解题思路
(1)在浸出过程中加入Na2SO3的目的是将Fe3+、Co3+ 还原为Fe2+、Co2+。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+;
(3)R3++3H2O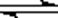
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,得到是MgF2、CaF2的过饱和溶液,根据溶液中氟离子的浓度相等,则所得滤液c(Mg2+)/ c (Ca2+)=Ksp(MgF2)/Ksp(CaF2)=7.35×10-11/1.05×10-10=0.7
(5)根据萃取剂对金属离子的萃取率与pH的关系。滤液Ⅱ中加入萃取剂的作用是除掉锰离子;使用萃取剂适宜的pH是接近3.0;
(6)NH4+ 的水解平衡常数Kh=10-14/1.8×10-5 =5.55×10-10 ;C2O42-的水解平衡常数Kh=10-14/5.4×10-5 =1.85×10-10 ;(7)600℃以前A点是隔绝空气加热,CoC2O4·2H2O失去水分,质量减少了3.6g,生成0.1mol CoC2O4;
600℃以前B点是隔绝空气加热,质量减少了8.8g,0.1mol CoC2O4失去全部碳和氧元素,生成Co;
600℃以后是在空气中加热,C点质量增加2.13g,n(Co)=0.1mol,n(O)=0.133mol,所示产物的化学式是Co3O4。
易错点
本题考查了化学计算等相关知识,难度较大,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力。
知识点
某化学兴趣小组进行“Fe2+”与“Fe3+”转化实验:向FeCl2溶液中加入少量KSCN溶液,溶液无明显变化,再加入少量双氧水,溶液变红,继续滴加至过量,发现溶液红色褪去,同时有气泡生成。他们针对此异常现象展开探究,请回答有关问题:
(1)该小组对于产生气体的原因有两种猜测:
猜测一:____________________________________________
猜测二:红色退去可能是SCN- 被H2O2氧化,同时产生的气体中可能含有氮气、二氧化碳、二氧化硫。
(2)化学小组针对猜测二设计下面的实验来验证气体成分:
试管A中盛放品红溶液,若实验中品红溶液褪色,证明气体中含有 ;试管B中的溶液是酸性高锰酸钾溶液,其目的是 ,预期试管B中的现象是 ;试管C中盛有澄清石灰水,目的是_________________________________;试管D和烧杯的作用是____________________。以上实验证明SCN- 能被H2O2氧化。请写出该反应的离子方程式:
(3)根据题目信息及以上实验推断,Fe2+ 和SCN- 中还原性较强的是_________,理由是____________________________________________________________。
(4)有学生认为SCN- 的氧化产物可能还有硫酸根离子,请设计一个简单实验证明该假设是否正确。
__________________________________________________________________________________________________________________________________________
正确答案
见解析。
解析
(1)氯化亚铁被过氧化氢氧化为氯化铁,在氯化铁的催化作用下过氧化氢分解,放出了氧气。
(2) SO2 ;除尽气体中的SO2,溶液颜色变浅但未褪色;
证明气体中还含有CO2;收集生成的N2
9H2O2 + 2SCN- + 2H+ = 2SO2↑ + 2CO2↑ + N2↑ + 10 H2O
(3)Fe2+,向FeCl2 和 KSCN溶液中加入少量双氧水,溶液变红,说
明双氧水优先和Fe2+反应。
(4)取烧瓶中褪色后的溶液少许,加盐酸酸化后再滴入几滴BaCl2溶液,溶液
变浑浊,证明该反应生成了硫酸根离子。
知识点
7.在含有


正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3 SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,实验作者设计这个实验的目的是_______________
_____________________________。
实验Ⅱ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是___________________。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是____________________________________。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为_________________________。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是_________________________________。
实验Ⅲ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ。实验Ⅱ、Ⅲ产生的现象完全相同。由上述实验得出的结论是______________________________________。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是_________________________________________。从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①( )
②( )
正确答案
实验Ⅰ:检验Na2SO3是否变质(或检验Na2SO3溶液中是否混有Na2SO4)
实验Ⅱ:氢氧化铁胶体(或胶体);先产生红褐色沉淀,后沉淀逐渐溶解,溶液变为黄色,有气泡产生;Fe3++3SCN-=Fe(SCN)3;Ba2++SO42-=BaSO4↓。
实验III:Fe3+与SO32-同时发生氧化还原反应和双水解反应2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
①SO32-有较强的还原性,CO32-没有还原性;②SO32-水解能力较CO32-小
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析