- 铁盐和亚铁盐的相互转变
- 共25题
6.下列反应的产物中,只存在+3价铁元素或氮元素的是
正确答案
解析
A.过量的铁丝在氯气燃烧,只能生成FeCl3,故选A;
B.过量的铁粉与溴水反应,生成的溴化铁最终被过量的铁还原为溴化亚铁;
C.2NO2+2NaOH=NaNO3+NaNO2+H2O;
D.2Cu(NO3)2 
考查方向
解题思路
熟悉相关物质的化学性质。
易错点
“过量的铁丝在氯气燃烧”与溶液中的过量铁的反应混淆而漏选A。
知识点
氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
8.试写出吸收塔中吸收剂Q反应的离子方程式: 。
9.六水合氯化铁在水中的溶解度如下:
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。再由FeCl3·6H2O晶体得到无水FeCl3的操作是: 。
10.常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=4×10-38)。
11.氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式 。
12.向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式 。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释 。
正确答案
2Fe2+ + Cl2= 2Fe3+ + 2Cl-
解析
吸收剂Q为氯化亚铁,尾气主要成分为氯气,二者反应的离子方程式为:
2Fe2+ + Cl2= 2Fe3+ + 2Cl-
考查方向
解题思路
本题首先分析氯化铁制备的工艺流程,得出两条制备线:主线是通过铁屑在氯气中燃烧得到氯化铁固体,再经过捕集、冷却直接得到无水氯化铁;支线是利用氯化亚铁吸收主线产生的尾气中的氯气,再向形成的氯化铁溶液中加入少量盐酸,加热浓缩、冷却结晶、过滤、洗涤、干燥得到FeCl3·6H2O晶体,再在干燥的HCl气流中加热得到无水氯化铁。
易错点
本题容易在利用化学平衡移动的原理解释问题方面出现错误。
正确答案
蒸发浓缩 冷却结晶 将FeCl3·6H2O晶体在干燥的HCl气流中加热
解析
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、蒸发浓缩,冷却结晶、过滤、洗涤、干燥;再由FeCl3·6H2O晶体得到无水FeCl3的操作是:将FeCl3·6H2O晶体在干燥的HCl气流中加热
考查方向
解题思路
本题首先分析氯化铁制备的工艺流程,得出两条制备线:主线是通过铁屑在氯气中燃烧得到氯化铁固体,再经过捕集、冷却直接得到无水氯化铁;支线是利用氯化亚铁吸收主线产生的尾气中的氯气,再向形成的氯化铁溶液中加入少量盐酸,加热浓缩、冷却结晶、过滤、洗涤、干燥得到FeCl3·6H2O晶体,再在干燥的HCl气流中加热得到无水氯化铁。
易错点
本题容易在利用化学平衡移动的原理解释问题方面出现错误。
正确答案
4.0×10-8
解析
常温下,溶液的pH=4时,c(OH-)=1.0×10-10mol·L-1,而此时:
Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4×10-38,故可求出c(Fe3+)=4.0×10-8 mol·L-1
考查方向
解题思路
本题首先分析氯化铁制备的工艺流程,得出两条制备线:主线是通过铁屑在氯气中燃烧得到氯化铁固体,再经过捕集、冷却直接得到无水氯化铁;支线是利用氯化亚铁吸收主线产生的尾气中的氯气,再向形成的氯化铁溶液中加入少量盐酸,加热浓缩、冷却结晶、过滤、洗涤、干燥得到FeCl3·6H2O晶体,再在干燥的HCl气流中加热得到无水氯化铁。
易错点
本题容易在利用化学平衡移动的原理解释问题方面出现错误。
正确答案
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
解析
SO2通入氯化铁溶液中反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
考查方向
解题思路
本题首先分析氯化铁制备的工艺流程,得出两条制备线:主线是通过铁屑在氯气中燃烧得到氯化铁固体,再经过捕集、冷却直接得到无水氯化铁;支线是利用氯化亚铁吸收主线产生的尾气中的氯气,再向形成的氯化铁溶液中加入少量盐酸,加热浓缩、冷却结晶、过滤、洗涤、干燥得到FeCl3·6H2O晶体,再在干燥的HCl气流中加热得到无水氯化铁。
易错点
本题容易在利用化学平衡移动的原理解释问题方面出现错误。
正确答案
Fe(OH)3 Fe3+会水解产生较多的H+:Fe3++ 3H2O
解析
氯化铁溶液中的Fe3+会发生如下水解:Fe3++ 3H2O
考查方向
解题思路
本题首先分析氯化铁制备的工艺流程,得出两条制备线:主线是通过铁屑在氯气中燃烧得到氯化铁固体,再经过捕集、冷却直接得到无水氯化铁;支线是利用氯化亚铁吸收主线产生的尾气中的氯气,再向形成的氯化铁溶液中加入少量盐酸,加热浓缩、冷却结晶、过滤、洗涤、干燥得到FeCl3·6H2O晶体,再在干燥的HCl气流中加热得到无水氯化铁。
易错点
本题容易在利用化学平衡移动的原理解释问题方面出现错误。
14.已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。
下列有关说法中,不正确的是
正确答案
解析
A.根据还原剂还原性强于还原产物的判断方法,可知该选项正确。
B.从图形的各曲线的起点能判断出各离子的起始物质的量分别为2/4/6mol,通入氯气后,根据还原性的强弱能判断出离子的分别为碘离子、亚铁离子、溴离子,故正确。
C.通入氯气先氧化碘离子,1mol氯气恰好能完全氧化溶液中的碘离子,故错误。
D.根据B的分析可知该选项正确。
考查方向
解题思路
找准图形中关于离子物质的量的关系,准确判断出氧化性和还原性强弱得出反应的发生顺序。
易错点
氧化性、还原性强弱的比较,离子反应与量的关系
知识点
高铁酸钾(K2FeO4)是一种理想的绿色高效水处理剂。某学习小组用下图所示装置(夹持仪器已略去)制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备K2FeO4。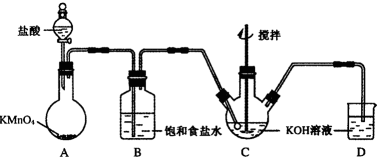
23.仪器C和D中都盛有KOH溶液,其中C中KOH溶液的用途是_________________。
24.Cl2与KOH的浓溶液在较高温度下反应生成KClO3。为保证反应生成KClO,需要将反应温度控制在0~5℃下进行,在不改变KOH溶液浓度的前提下,实验中可以采取的措施是__________________。
25.在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2FeO4,写出该反应的化学方程式___________;该操作不能将KClO饱和溶液滴加到Fe(NO3)3饱和溶液中,其原因是____________________。
26.制得的粗产品中含有Fe(OH)3、KCl等杂质。一种提纯方案为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥。 ①第一次和第二次过滤得到的固体分别对应的是(填化学式)______________、___________,过滤时不用普通漏斗而采用砂芯漏斗的原因是_____________________②晶体用乙醇洗涤的原因是________________________。
正确答案
和氯气反应制备KClO
解析
从题意中不难发现该装置目的是制备KClO,因此必须氯气与氢氧化钾反应,从实验的绿色、环保角度就不难发现D需要吸收尾气。
考查方向
解题思路
物质制备是中学化学实验教学的重要组成部分,也是高考对学生实验综合分析能力考查的重要载体,题型多变、涉及知识面广、思维发散空间大,这类题目或重现课本重要实验、或整合课本实验、或对课本实验进行探究创新,立足教材而又高于教材,准确把握制备物质的性质,充分考虑实验设计的安全、科学、合理、严谨、绿色。
易错点
题目给出的物质性质信息理解偏差
正确答案
装置C加冰水浴冷却
解析
因为Cl2与KOH的浓溶液在较高温度下反应生成KClO3。所以过程中必须保重反应物浓度较低且温度不能过高,这就必须采用冷却装置。
考查方向
解题思路
物质制备是中学化学实验教学的重要组成部分,也是高考对学生实验综合分析能力考查的重要载体,题型多变、涉及知识面广、思维发散空间大,这类题目或重现课本重要实验、或整合课本实验、或对课本实验进行探究创新,立足教材而又高于教材,准确把握制备物质的性质,充分考虑实验设计的安全、科学、合理、严谨、绿色。
易错点
题目给出的物质性质信息理解偏差
正确答案
2Fe(NO3)3 + 3KClO +10 KOH = 2K2FeO4 +3KCl + 6KNO3+5H2O 生成的K2FeO4在Fe3+催化作用下会发生分解
解析
滴加顺序的改变对实验结果影响较大,将KClO饱和溶液滴加到Fe(NO3)3饱和溶液中,意味着硝酸铁溶液开始过量溶液中存在大量的三价铁离子,而Fe3+和Fe(OH)3催化作用下发生分解目标产物,所以需要避免Fe3+的出现,化学方程式的书写需要准确判断反应物和生成物,可知该反应为氧化还原反应,配平需要采用氧化还原配平方法保证得失电子相等。
考查方向
解题思路
物质制备是中学化学实验教学的重要组成部分,也是高考对学生实验综合分析能力考查的重要载体,题型多变、涉及知识面广、思维发散空间大,这类题目或重现课本重要实验、或整合课本实验、或对课本实验进行探究创新,立足教材而又高于教材,准确把握制备物质的性质,充分考虑实验设计的安全、科学、合理、严谨、绿色。
易错点
题目给出的物质性质信息理解偏差
正确答案
①Fe(OH)3 K2FeO4 滤纸在强碱条件下易被腐蚀②乙醇挥发时带走水分,防止K2FeO4与水发生反应
解析
粗产品为固体混合物,且氢氧化铁是一种难溶物质,根据可溶于水这一特征,采用重结晶的方法能将其分离,因此第一次分离的固体为氢氧化铁,第二次应用到重结晶方法,分理处的固体为K2FeO4 ,为除去水分达到干燥,利用乙醇的易挥发性带走固体表面的水
考查方向
解题思路
物质制备是中学化学实验教学的重要组成部分,也是高考对学生实验综合分析能力考查的重要载体,题型多变、涉及知识面广、思维发散空间大,这类题目或重现课本重要实验、或整合课本实验、或对课本实验进行探究创新,立足教材而又高于教材,准确把握制备物质的性质,充分考虑实验设计的安全、科学、合理、严谨、绿色。
易错点
题目给出的物质性质信息理解偏差
19.草酸亚铁晶体(FeC2O4·2H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,也常用作分析试剂及显影剂等,其制备流程如下:
(1)配制硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液时,需加少量硫酸,目的是_______________。
(2)加热到沸腾时发生反应的化学方程式为______________________。
(3)向盛有草酸亚铁晶体的试管中滴入硫酸酸化的KMnO4溶液,振荡,溶液变为棕黄色, 同时有气体生成。已知反应中MnO4-转化为无色的Mn2+,则该过程中被氧化的元素是_________。若反应中消耗l mol FeC2O4·2H2O,则参加反应的n(KMnO4)=______。
(4)草酸亚铁晶体在氩气气氛中进行热分解,结果如下图所示(TG%表示残留固体质 量占原样品总质量的百分数),请回答下列问题:
①A→B发生反应的化学方程式为________________。
②精确研究表明,B→C实际上是分两步进行的,每一步只释放一种气体,第二步释放的气体相对分子质量较第一步大,则第一步释放的气体的化学式是_______;释放第二种气体时的化学方程式为___________。
正确答案
(1)抑制Fe2+水解;
(2)(NH4)2Fe(SO4)2+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4+(NH4)2SO4;
(3)铁、碳;0.6mol;
(4)①FeC2O4·2H2O

解析
(1)Fe2+易水解,配制硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液时,需加少量硫酸,目的是抑制Fe2+水解;
(2)加热到沸腾时,(NH4)2Fe(SO4)2和H2C2O4反应生成FeC2O4·2H2O、H2SO4、(NH4)2SO4;化学方程式为(NH4)2Fe(SO4)2+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4+(NH4)2SO4;
(3)向盛有草酸亚铁晶体的试管中滴入硫酸酸化的KMnO4溶液,振荡,溶液变为棕黄色,同时有气体生成。说明亚铁离子被氧化成铁离子,同时生成了二氧化碳,,则该过程中被氧化的元素是铁、碳;若反应中消耗l mol FeC2O4·2H2O,失电子为3mol,则参加反应的n(KMnO4)=0.6mol;
(4)FeC2O4·2H2O相对分子质量为180,设FeC2O4·2H2O为1mol,第一步反应后减少36g,正好是2molH2O;第二步反应后,剩余质量为72g,是FeO;第二步生成气体72g,是一氧化碳和二氧化碳的混合气体,物质的量之比1:1;
①通过剩余固体的质量可知,过程Ⅰ发生的反应是草酸亚铁晶体受热失去结晶水,反应的化学方程式为:FeC2O4·2H2O
②精确研究表明,B→C实际上是分两步进行的,每一步只释放一种气体,第二步释放的气体相对分子质量较第一步大,则第一步释放的气体的化学式是CO;释放第二种气体时的化学方程式为FeCO3
考查方向
解题思路
(1)Fe2+易水解,配制硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液时,需加少量硫酸,目的是抑制Fe2+水解;
(2)加热到沸腾时,(NH4)2Fe(SO4)2和H2C2O4反应生成FeC2O4·2H2O、H2SO4、(NH4)2SO4;
(3)向盛有草酸亚铁晶体的试管中滴入硫酸酸化的KMnO4溶液,振荡,溶液变为棕黄色,同时有气体生成。说明亚铁离子被氧化成铁离子,同时生成了二氧化碳,,则该过程中被氧化的元素是铁、碳;若反应中消耗l mol FeC2O4·2H2O,失电子为3mol,则参加反应的n(KMnO4)=0.6mol;
(4)FeC2O4·2H2O相对分子质量为180,设FeC2O4·2H2O为1mol,第一步反应后减少36g,正好是2molH2O;第二步反应后,剩余质量为72g,是FeO;第二步生成气体72g,是一氧化碳和二氧化碳的混合气体,物质的量之比1:1;
①通过剩余固体的质量可知,过程Ⅰ发生的反应是草酸亚铁晶体受热失去结晶水,反应的化学方程式为:FeC2O4·2H2O
②精确研究表明,B→C实际上是分两步进行的,每一步只释放一种气体,第二步释放的气体相对分子质量较第一步大,则第一步释放的气体的化学式是CO;释放第二种气体时的化学方程式为FeCO3
易错点
加热分解产物分析
知识点
扫码查看完整答案与解析





