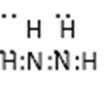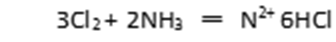- 元素周期律和元素周期表的综合应用
- 共63题
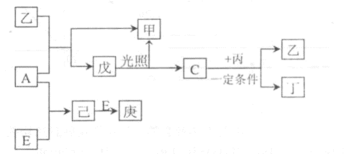
27. A、B、C、D、E为五种元素的单质,其余为化合物。其中只有E为金属元素,五种元素的原子序数按B、D、C、A、E顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙每个分子中均含有10个电子,下阁为相互转 化关系:
谘回答下列问题:
(1)下面是周期表的一部分,请将A、C、E用元素符号填在相应的位置上。
(2)写出工业上制取A反应的离子方程式_______________
(3)戊的分子式为_______.B与D形成的原子个数比为2:1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式______
(4)A与丙常温下发生反应生成甲与单质D,该反应的化学方程式_________
(5 )8gE在A中燃烧放山热摄QkJ,写出该反应热化学方程式________(热量是常温下测定的)。
(6)实验室配制庚溶液的实验方法是________。
正确答案
见解析。
解析
(1)
(2)
(3)HClO
(4)
(5)
(6)向盐酸中加入适量的FeCl2晶体,搅拌溶解,然后加水稀释,并加入少许铁粉。
知识点
10.短周期元素X、Y、Z、R在周期表中的位置如图。下列说法正确的是()
正确答案
解析
略
知识点
34.请从34-36题中任选一题作答。
34.[化学选修一化学与技术]
钡盐行业生产中排出大量的钡泥,其主要万分有BaCO3,BaSiO3,BaSO3,Ba(FeO2)2等,某主要生产BaCl2,BaCO3,BaSO4的化工厂利用钡泥生产Ba(NO3)2.其部分工艺如下:
(1)分离出Ba(NO3)2的操作I是( );化工生产流程条件的控制尤为重要,此生产过程酶溶时通常控制湿度不超过7( )℃,且不用浓硝酸,主要原因是( )。
(2)步骤I酸溶时BaSO3除发生BaSO3+2HNO3 Ba(NO3)2+ SO2↑+H2O外,还发生另一反应,写出反应的离子方程式:( )。
(3)根据该厂生产实际,中和:[加入 X应选用( );(填化学式)最后残渣中除少量BaS1O3,H2SiO3,及原有难溶性物质外,还含有( )。
(4)你认为该工艺设汁有哪些不足之处,提出你的合理建议( ) 。
35.[化学选修一物质结构与性质
图一:长式周期表的一部分(编号代表对应元素)
图二:②③④⑤⑥对应氢化物沸点
请回答下列问题:
(1)图一中属于P区的元素共有( )种;原子核外有5种运动状态不同的电子,该元素名称是 ( );14种元素中电负性最大的元素是 ( );(填元素符号)
(2)科学家发现④⑦⑩三种元素形成的晶体有超导作用,其晶胞结构如图所示,则该化合物化学式为 ( );晶体中每个⑦原子周围距离最近且等距离的⑩原子有( )个。
(3)①④⑥三种元素组成的一种化合物X是新装修居室中的一种有害气体;①④二种元素形成原子个数比为1:1的化合物Y是一种常见的有机溶剂,下列有关叙述正确的是( ):(填字母)A.X与水分子能形成氢键,Y是非极性分子B.Y分子中每个碳含有2个d键,1个兀键C.④⑥元素形成常见的化合物晶体熔点沸点都比SiO2晶体低,因为前者是分子晶体,后者是原子晶体。D.X与CO2分子中的中心原子均采用SP3杂化
(4)图二中,系列3对应的氢化物中心原子杂化方式是 ( );
系列1l对应的氢化物沸点比其他氢化物高的原因是 ( );
系列2对应的氢化物比系列3、4、5对应的氢化物沸点高的原因是( ) 。
36.[化学选修一有机化学基础]
某环烃X具有下列的转化关系:
已知:A的蒸汽密度是相同条件下H2密度的50倍,A中碳链无支链;
请回答下列问题:
(1)X申的官能团名称是____;反应③和⑤的反应类型分别是 ( )和 ( );
(2)A的结构简式为_;F的核磁共振氢谱共有( )峰;
(3)写出反应⑤的化学方程式( )。
(4)M与F为同系物,相对分子质量比F小14,写出两个符合条件的M的同分异构体的结构简式(不包括顺反异物)
正确答案
34.
35.
36.
解析
解析已在路上飞奔,马上就到!
知识点
27. W、X、Y、Z四种短周期元素在元素周期表中的位置如下图所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物。请回答下列问题。
(1)W元素形成的同素异形体的晶体类型可能是(填序号)( )。①原子晶体②离子晶体③分子晶体④金属晶体
(2)H2Y2的电子式为( )。
(3)在下图中,b是含有Fe2+和淀粉KI的水溶液,且溶液的pH约为7,a为H2Y2的水溶液,打开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成。当消耗1 mol Fe2+时,共转移3mol电子,该反应的离子方程式是( )。
(4)已知:298K时,金属钠与Y2气体反应,若生成l molNa2Y固体时,放出热量414 kJ;若生成1mol Na2Y2固体时,放出热量511 kJ。则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为( )。
(5)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入Z2的电极为原电池□的( )极,其电极反应式为( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
36.请从36-38题中任选一题作答
36.[化学—选修化学与技术]
根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
(1)①废水I若采用CO2处理,离子方程式是 ( )。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO-3)越大,净水效果越好,这是因为 ( )。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):
Hg2++ ( )=====CH3Hg++H+我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含Hg2+3×10-17mo1,是否达到了排放标准 ( )(填“是”或“否”)。
④废水Ⅳ常用C12氧化CN-成CO2和N2,若参加反应的C12与CN-的物质的量之比为5:2,则该反应的离子方程式为 ( )。
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化刹的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
I.取V1mL水样于锥形瓶,加入10.00 mL 0.2500 mol/L K2Cr2O7溶液。
II.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
III.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
①I中,量取K2Cr2O7,溶液的仪器是 ( ) 。
②III中,发生的反应为:Cr2O72-+6Fe2++14 H+==2Cr3++6Fe3++7H2O
由此可知,该水样的化学需氧量COD= ( )(用含c、V1、V2的表达式表示)。
37.[化学—选修物质结构与性质]
下表为长式周期表的一部分,其中的序号代表对应的元素。

(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为_____杂化;元素⑦与⑧形成的化合物的晶体类型是___________。
(3)元素④的第一电离能______⑤(填写“>”、 “=”或“<”)的第一电离能;元素④与元素①形成的X分子的空间构型为__________。请写出与元素④的单质互为等电子体分子、离子的化学式______________________(各写一种)。
(4)④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为___ ______。
(5)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为__________。
38.[化学~选修有机化学基础]
植物精油具有抗菌消炎、解热镇痛等药物功用。从樟科植物枝叶中提取的精油中含有下列甲、乙、丙三种成分:
(1)甲、乙中含氧官能团的名称分别为( )、( )。
(2)经下列过程甲可转化为乙:
①,②的反应类型分别为( )、( )。
(3)通过下列合成路线由乙可得到丙(部分反应产物略去)
已知:
①F的结构简式为( ) 。
②由乙制取D的化学方程式为( )。
③写出同时符合下列要求的D的同分异构体的结构简式( )。
a.化合物是二取代苯
b.分子中有5种不同环境的氢原子,其个数比为l:2:2:1:2
c.能使溴的CCl4溶液退色,且在酸性条件下可以发生水解反应
④丙的结构简式为( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如下图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质,已知,它们可以发生如下反应:甲+乙→丁+己,甲+丙→戊+己;0.1mol/L丁溶液的pH为13(25℃)。下列说法正确的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26. W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,Z与M的最低负化合价相同,X、M在周期表中位置如图所示。
(1)Q在周期表中的位置为( );
(2)Z与W形成的4核分子的结构式为( );
(3)由W、Y、Z、M组成的离子化合物在溶液中相互反应的离子方程式为:( )。
(4)W2与Z2反应生成化合物甲,W2与Q2反应生成化合物乙。
已知反应:
(5)X、Y可分别与Z以原子个数比1∶1形成化合物丙和丁。在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊。写出该反应的化学方程式:( ),该反应的平衡常数表达式为( );
(6)将1 mol丙气体和1 mol丁气体充入一装有催化剂的恒压容器中,充分反应达平衡后:
①若气体体积较原来减少20%,则丁的转化率为( );
②若仅将压强缩小为原来的一半,再次达平衡后,混合气体中丁的体积分数将( )(填变大、变小或不变)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.已知X、Y、Z、W是四种短周期非金属元素,在周期表中的相对位置如下图所示,下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析