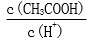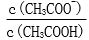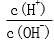- 氮气的化学性质
- 共19题
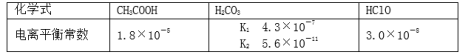
25℃时,三种酸的电离平衡常数如下:
回答下列问题:
25.一般情况下,当温度升高时,Ka ________(填“增大”、“减小”或“不变”).
26.下列四种离子结合
a. CO32-
b. ClO-
c. CH3COO-
d. HCO3-
27.下列反应不能发生的是________(填序号)
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO-
d. 2ClO-+CO2+H2O=CO32-+2HClO
28.用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________(填序号);
a.
b.
c.
d.
29.体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。
则HX的电离平衡常数________(填“大于”、“等于”或“小于”,下同)

30.25 ℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中
c(CH3COO-)-c(Na+)=________ mol·L-1(填精确数值)。
正确答案
增大
解析
Ka只跟温度有关,电离过程吸热,温度升高Ka增大。
考查方向
解题思路
Ka代表弱酸电离常数,只跟温度有关,电离过程吸热,利用勒夏特列原理分析即可得出答案。
易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
正确答案
a>b>d>c
解析
酸性越弱,对应的酸根离子结合质子(H+)能力越强,因为酸性:CH3COOH> H2CO3> HClO > HCO3-,所以CO32->ClO->HCO3->CH3COO-,即a>b>d>c。
考查方向
解题思路
质子即为H+,结合H+越容易,说明得到的对应的酸越弱,Ka会越小,结合表中Ka值即可得出答案。
易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
正确答案
c d
解析
根据强酸制弱酸原理,
反应a:酸性CH3COOH> H2CO3 ,符合;
反应b:酸性CH3COOH> HClO ,符合;
反应c:酸性HClO > H2CO3 ,不符合;
反应d:酸性HCO3-> HClO ,不符合;(因为HClO > HCO3- 故产物不是CO32-而是HCO3-)
考查方向
解题思路
Ka越大,酸性越强,即CH3COOH> H2CO3> HClO > HCO3-,再结合强酸制弱酸原理去分析a、b、c、d四个反应即可得出答案。
易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
正确答案
b
解析
CH3COOH溶液中存在两个电离平衡:CH3COOH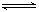



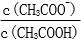
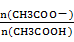
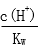
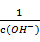
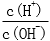
考查方向
解题思路
CH3COOH溶液中存在两个电离平衡:CH3COOH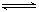

易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
正确答案
大于;大于; 稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱
解析
由图可知:稀释前:PH(HX)= PH(CH3COOH)=2,稀释100后: PH(CH3COOH)< PH(HX)<4,说明HX存在电离平衡即为弱酸,但酸性比CH3COOH强,故HX电离平衡常数大于醋酸的电离平衡常数;由于HX自身电离出的H+大于醋酸电离出的H+,根据C(H+)越大对水的电离平衡越抑制,导致水电离的H+浓度越小,故HX溶液中水电离出来的c(H+)小于醋酸溶液中水电离出来的c(H+)。
考查方向
解题思路
由图可知未稀释前PH相同,稀释相同倍数后HX的PH变化大于CH3COOH,说明酸性:HX>CH3COOH,另外这一过程溶液由10ml稀释到1000ml即稀释了100倍,稀释前后HX的PH变化小于2,说明HX是弱酸。其他的根据电离平衡影响因素分析即可。
易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
正确答案
9.9×10-7 moL·L-1
解析
混合溶液pH=6,说明c(H+)=10-6mol/l,c(OH-)=10-8mol/l,根据电荷守恒:
c(H+)+c(Na+)=c(CH3COO-)+ c(OH-)可得:c(CH3COO-)-c(Na+)=c(H+) -c(OH-)=10-6-10-8mol·L-1=9.9×10-7 moL·L-1
考查方向
解题思路
根据溶液中阴阳离子电荷守恒分析即可得出答案。
易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
10.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
正确答案
D
解析
A.铝热反应为放热反应,结论不合理,故A错误;
B.向鸡蛋清溶液中加入饱和(NH4)2SO4溶液发生盐析,而不是变性,重金属盐可使蛋白质变性,故B错误;
C.硫酸钙和碳酸钙阴离子和阳离子比相同,可以直接比较溶解度和溶度积常数,处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解,发生了沉淀转化,Ksp:CaCO3<CaSO4,故C错误;
D.因为NaHCO3的溶解度比Na2CO3的小,所以向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊,有因果关系,故D正确.
故选D.
考查方向
化学实验方案的评价
解题思路
A.铝热反应为放热反应;
B.重金属盐可使蛋白质变性;
C.沉淀向更难溶的方向转化;
D.NaHCO3的溶解度比Na2CO3的小.
易错点
本题不容易把握实验的严密性和可行性的评价。
知识点
10.酸碱质子理论认为凡是能给出质子的离子或分子都是酸;凡是能接受质子的离子或分子都是碱。物质的酸性或碱性强弱
正确答案
解析
A、活泼金属与水发生的氧化还原反应,而不是酸碱反应,故A错误;
B、S2-接受质子是碱,而H2O给出质子是酸,所以S2-+H2O
C、物质碱性的强弱取决于分子或离子接受质子能力的大小,接受质子能力:OH->ClO->CH3COO-,则碱性顺序:OH->ClO->CH3COO-,故C错误;
D、NH3可以结合质子是碱,HCO3-既可以给出质子也可以接受质子,所以既是酸又是碱,故D错误;
考查方向
酸碱质子理论、电离、水解
解题思路
酸碱质子理论:凡是能够给出质子(H+)的物质都是酸、凡是能够接受质子的物质都是碱,所以所有酸都能够释放出H+,能结合H+的都是碱.为酸碱两性物质的是属于酸又属于碱,必须符合能给出质子又能结合质子,据此即可解答
易错点
酸碱质子理论中的酸、碱、两性物质
教师点评
本题考查酸碱质子理论,解答本题关键是要严格按照酸与碱的定义考虑,是能给出质子(H+)还是能接受质子,题目难度不大
知识点
13. 下图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是
正确答案
解析
“侯氏制碱法”制取NaHCO3的原理是在饱和食盐水中通入氨气和二氧化碳,而得到NaHCO3,
为防止倒吸,a管通NH3,b管通CO2,故A、C错误;
由于CO2在水中的溶解度较小,而NH3的溶解度较大,所以要在食盐水先通NH3然后再通CO2,否则CO2通入后会从水中逸出,等再通NH3时溶液中CO2的量就很少了,这样得到的产品也很少,故B正确、D错误;
考查方向
实验装置的综合应用、侯氏制碱法原理
解题思路
“候氏制碱法”制取NaHCO3的原理 是在饱和食盐水中通入氨气和二氧化碳,而得到NaHCO3;在这一实验过程中,由于CO2在水中的溶解度较小,而NH3的溶解度较大,为防止倒吸,b管通CO2,a管通NH3,所以要向食盐水中先通NH3再通CO2,否则CO2通入后会从水中逸出,再通NH3时溶液中CO2的量很少,得到的产品很少;在这个实验中的尾气主要是CO2和NH3,其中NH3对环境影响较大,要进行尾气处理,而NH3是碱性气体,所以在c装置中要装酸性物质,据此进行推断
易错点
常见装置特点及使用方法
教师点评
本题主要考查实验装置的综合应用、侯氏制碱法原理,题目难度中等,明确侯氏制碱法原理为解答关键,试题培养了学生的分析能力及化学实验能力
知识点
11.已知某溶液中含有碳酸钠、硫酸钠、氢氧化钠、氯化钠四种溶质,欲将该溶液中四种溶质的阴离子逐一检验出来,所加试剂先后顺序合理的是
正确答案
解析
先加硝酸,氢离子与碳酸根离子生成气体,可以鉴别出碳酸钠,但硝酸也可和氢氧化钠反应生成水,没有明显现象,又除去了氢氧根离子,故A、B错误;
铵根离子与氢氧根离子反应生成具有刺激性气味的气体,加入硝酸铵可以证明氢氧化钠的存在;再加入稀硝酸,有气体生成,证明含有碳酸钠;加入硝酸钡,钡离子与硫酸根离子生成硫酸钡沉淀,可以证明含有硝酸钡;最后加入硝酸银,银离子与氯离子反应生成氯化银白色沉淀,证明含有氯化钠,可以将四种溶质都证明出来,如先加入硝酸银,则硫酸银、氯化银都生成沉淀,不能鉴别,故C正确、D错误
考查方向
物质的检验和鉴别
解题思路
检验氢氧化钠,可加入铵盐,生成刺激性气味的气体,然后加入硝酸检验碳酸钠,加入硝酸钡检验硫酸钠,过滤后加入硝酸银检验氯化钠,注意加入试剂不能干扰其它离子的,以此解答该题
易错点
所加试剂能否逐一鉴别
教师点评
本题考查物质的检验和鉴别,为高考常见题型,侧重学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握物质的性质的异同以及实验的严密性,难度不大
知识点
扫码查看完整答案与解析