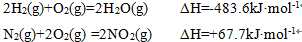- 氮气的化学性质
- 共19题
18. 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是__________(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是_________(填字母序号)。
a. 海洋中存在游离态的氮
b. 海洋中的氮循环起始于氮的氧化
c. 海洋中的反硝化作用一定有氧气的参与
d. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:
NH4+ + 5O2 === 2NO2- + H+ +_________+_________
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
硝化细菌去除氨氮的最佳反应温度是_________,在最佳反应温度时,48 h内去除氨氮
反应的平均速率是_________mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。下图是间接氧化工业废水中氨氮(NH4+)的示意图。
① 结合电极反应式简述间接氧化法去除氨氮的原理:_________________。
② 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH
将_________(填“增大”、“不变”或“减小”),请简述理由:__________________。
正确答案
(1)②
(2) ad
(3)4NH4+ + 5O2 === 2NO2- + 6H+ + N2O + 5H2O
(4)25℃ 1.125
(5)① 阳极反应Cl- -2e- = Cl2 产生的Cl2氧化废水中的NH4+释放出N2
② 减小,理由:电路中通过相同电量时,若生成n (H2):n (N2)=3:1,则阳极产生的H+比阴极消耗的H+多。
解析
(1)由图中信息可以看出海洋中的氮循环中属于固氮作用的一步是将N2转化为NH4+的过程,所以是图中的序号②;
(2)同样由图中信息可以看出海洋中存在游离态的氮,所以a正确;且由于向海洋排放含NO3-的废水会反硝化生成N2,而N2可以转化为NH4+,进而影响海洋中NH4+的含量,d正确;海洋中的氮循环起始于N2转化为NH4+的过程,这个过程是氮的还原过程,b错误,海洋中的反硝化作用一定是发生了氧化反应,但是不一定有氧气的参与,c错误;
(3)5个O2反应要转移20个电子,而2NH4+ 转化为2NO2- 转移12个电子,所以还有8个电子则一定有2个 N2O生成,再根据电荷守恒和原子守恒配平并补充H+,即离子方程式为:4NH4+ + 5O2 === 2NO2- + 6H+ + N2O + 5H2O ;
(4)由图中信息可以看出25℃时硝化细菌去除氨氮时氨氮含量最低,所以硝化细菌去除氨氮的最佳反应温度是25℃;在25℃时,48 h内去除氨氮反应的质量为=1008-468=540mg,所以反应速率=[540mg÷(10L)]÷48h=1.125mg·L-1·h-1;
(5)①由图中信息可以看出阳极有Cl2产生,所以阳极的电极反应为:Cl- -2e- = Cl2 ,而废水中的NH4+具有还原性,可以被Cl2氧化N2释放出;
②当电路中通过相同电量时,生成n (H2):n (N2)=3:1,则阳极产生的H+比阴极消耗的H+多,所以溶液中H+浓度增大,则溶液的pH减小;
考查方向
以氮元素在海洋中的循环为载体,考查有关图表信息、氮的固定、离子型氧化还原反应方程式的配平、实验条件的控制、反应速率的计算、电化学原理的应用和计算等。
解题思路
(1)由图中信息可以看出海洋中的氮循环中属于固氮作用的一步是将N2转化为NH4+的过程;
(2)同样由图中信息可以看出海洋氮循环的说法正确的是_______(填字母序号)。
a.海洋中存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.海洋中的反硝化作用一定有氧气的参与
d.向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)4NH4+ + 5O2 === 2NO2- + 6H+ + N2O + 5H2O
(4)25℃ 1.125
(5)① 阳极反应Cl- -2e- = Cl2 产生的Cl2氧化废水中的NH4+释放出N2
② 减小,理由:电路中通过相同电量时,若生成n (H2):n (N2)=3:1,则阳极产生的H+比阴极消耗的H+多。
易错点
不能准确观察和整合题给信息;配平方程式时不能有效使用电荷守恒进行配平;不能根据电子守恒分析电极反应中H+的变化,进而分析pH 的变化。
知识点
14.向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)

正确答案
解析
A.从图中可以看出,随反应进行反应物浓度减小,而正反应速率增大,说明体系温度升高,故正反应是放热反应,所以A正确;B.因为随反应进行反应物浓度减小,故反应物浓度:a点大于b点,b点大于c点,即a>b>c,所以B错误;C.反应在c点,反应速率仍在变化,说明反应仍在进行,故未达到平衡状态,所以C错误;D.在恒温恒容容器中,热量可以散失,所以平衡后容器的温度低于绝热恒容密闭容器中的温度,则在恒温恒容容器中反应进行程度大,SO2的转化率大,所以D错误。
考查方向
解题思路
A.因为随反应进行反应物浓度减小,而正反应速率增大,说明体系温度升高,故正反应是放热反应;B.因为随反应进行反应物浓度减小,故反应物浓度:a点大于b点,b点大于c点;C.反应在c点,反应速率仍在变化,说明反应仍在进行,故未达到平衡状态,D.若在恒温恒容容器中,以相同的投料进行该反应,平衡后容器的温度低于绝热恒容密闭容器中的温度,则在恒温恒容容器中反应进行程度大,SO2的转化率大。
易错点
绝热恒容密闭容器中的温度随着反应的进行要发生变化。
知识点
6.下列关于氮的固定的说法错误的是
正确答案
解析
氮的固定是将游离态的氮转化成化合态的氮,因此必然发生氧化还原反应,自然界的固氮可以转化成氮的氧化物或铵态氮,因此氮元素的化合价在固定过程中极可能别氧化也可能被还原。故选择C
考查方向
解题思路
准确把握氮的固定概念
易错点
概念认知错误
知识点
9.下列表示对应化学反应的离子方程式正确的是( )
正确答案
解析
A.NO2通入水中离子方程式为:3NO2+H2O═2H++2NO3-+NO,故A正确;
B.用两个铜电极电解CuSO4溶液,阳极铜失电子生成铜离子,阴极氢离子得到电子生成氢气,反应的化学方程式:Cu+2H2O
C.SO2通入FeCl3溶液中:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+,故C错误;
D.过量的CO2通入NaAlO2溶液中生成氢氧化铝和碳酸氢钠:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D错误;
故选A。
考查方向
解题思路
A.NO2通入水中离子方程式为:3NO2+H2O═2H++2NO3-+NO;
B.用两个铜电极电解CuSO4溶液,阳极铜失电子生成铜离子,阴极氢离子得到电子生成氢气,反应的化学方程式:Cu+2H2O
C.SO2通入FeCl3溶液中:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+;
D.过量的CO2通入NaAlO2溶液中生成氢氧化铝和碳酸氢钠:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
易错点
本题考查了离子方程式正误判断,明确物质的性质是解本题关键,再结合氧化还原反应、物质的溶解性、溶液的酸碱性等知识点来解答,易错选项是D,要考虑过量的CO2,为易错点。
知识点
氮氧化物是造成雾霾天气的主要原因之一。消除氮氧化物有多种方法。
25.硝酸厂常用催化还原法处理尾气:催化剂存在时用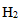
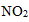
已知:
则H2还原NO2生成水蒸气反应的热化学方程式是 。
26.NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是2NH3(g)+NO(g)+NO2(g) 
27.利用ClO2氧化氮氧化物反应过程如下:NO 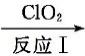
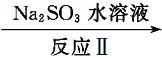
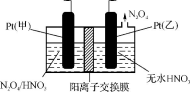
28.工业废气中含有的NO2还可用电解法消除。用NO2为原料可制新型绿色硝化剂N2O5。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,如图。Pt(甲)为 极,电解池中生成N2O5的电极反应式是 。
正确答案
1;4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=-1034.9kJ·mol-1
解析
①2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1,
②N2(g)+2O2(g) =2NO2(g) ΔH=+67.7kJ·mol-1,
由①×2-②得:4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=-483.6kJ·mol-1×2-67.7kJ·mol-1=-1034.9kJ·mol-1,
故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=-1034.9kJ·mol-1;
考查方向
氮的氧化物的性质及其对环境的影响;用盖斯定律进行有关反应热的计算;电解原理。
解题思路
根据盖斯定律来写热化学方程式;
易错点
本题涉及热化学方程式、化学平衡移动、化学计算、电解原理等知识点,题目难度较高。
正确答案
增大NH3浓度(或减小压强、降低温度)
解析
增大NH3浓度、减小压强、降低温度平衡正向移动,氮氧化物的转化率增大,故答案为:增大NH3浓度(或减小压强、降低温度);
考查方向
氮的氧化物的性质及其对环境的影响;用盖斯定律进行有关反应热的计算;电解原理。
解题思路
根据增大NH3浓度、增大压强、降低温度平衡正向移动,氮氧化物的转化率增大;
易错点
本题涉及热化学方程式、化学平衡移动、化学计算、电解原理等知识点,题目难度较高。
正确答案
2NO2+4Na2SO3=N2+4Na2SO4 67.5
解析
二氧化氮具有氧化性,能氧化Na2SO3生成Na2SO4,本身被还原成氮气,方程式为2NO2+4Na2SO3═N2+4Na2SO4,故答案为:2NO2+4Na2SO3═N2+4Na2SO4;由2NO+ClO2+H2O═NO2+HNO3+2HCl,2NO2+4Na2SO3═N2+4Na2SO4得: 2ClO2 ~N2 135g 22.4L67.5g 11.2L所以共消耗ClO267.5g,故答案为:67.5;
考查方向
氮的氧化物的性质及其对环境的影响;用盖斯定律进行有关反应热的计算;电解原理。
解题思路
根据二氧化氮具有氧化性,能氧化Na2SO3生成Na2SO4,本身被还原成氮气;通过化学方程式建立关系式然后计算;
易错点
本题涉及热化学方程式、化学平衡移动、化学计算、电解原理等知识点,题目难度较高。
正确答案
阳极 N2O4+2HNO3-2e-=2N2O5+2H+
解析
从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,反应式为N2O4+2HNO3-2e-=2N2O5+2H+,故答案为:阳;N2O4+2HNO3-2e-=2N2O5+2H+。
考查方向
解题思路
由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成。
易错点
本题涉及热化学方程式、化学平衡移动、化学计算、电解原理等知识点,题目难度较高。
扫码查看完整答案与解析