- 化学平衡移动原理
- 共39题
greece
正确答案
碳及其化合物在科技、社会生产、生活中有着广泛的应用。请按要求回答下列问题:
23.已知:2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1=﹣1214.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) △H2=﹣566 kJ/mol
请写出CH4燃烧热的热化学方程式:______________________________________。
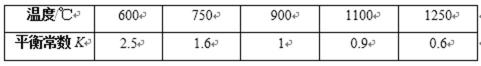
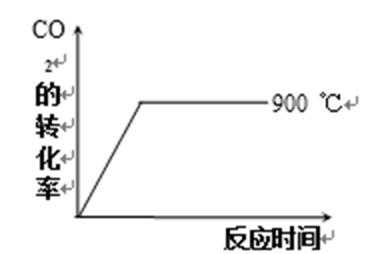
24.在不同温度下反应CO2(g)+H2(g) 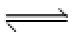
其他条件相同时,请在下图中画出750℃时CO2的转化率随时间变化的示意图。
25.以二甲醚(CH3OCH3)、空气、KOH溶液为原料可设计为燃料电池
①放电时,负极电极反应式:______________________________________。
②假设该燃料电池中盛有100.0 mL 3.0 mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为6.72 L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为_____________________________________________。
正确答案
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol
考查方向
本题考查了热化学方程式的书写及燃烧热的概念
解题思路
根据燃烧热的定义,写方程式是可燃物只能是1mol:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=1/2△H1+1/2 △H2=-890.3 kJ/mol
易错点
忽略可燃物只能是1mol,即燃烧热的定义。
教师点评
本题考查了热化学方程式的书写,盖斯定律的应用及燃烧热的定义,在高考中出现频率高。
正确答案
考查方向
本题考查了化学平衡常数、化学平衡移动,化学反应速率,图像等知识点及学生分析图表获取信息的能力。
解题思路
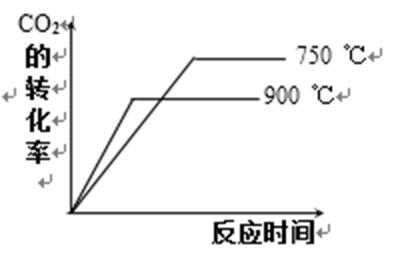
根据第一空,该反应为放热反应,750。C时,温度降低,速率减慢,达到平衡的时间变长,拐点延后,但平衡正移,二氧化碳转化率增大,平台高。
易错点
平衡移动和反应速率的影响结果混淆。
教师点评
本题考查了化学平衡常数、化学平衡移动,化学反应速率,图像等知识点及学生分析图表获取信息的能力。在高考中出现频率较高,但全国卷对该部分内容的考查难度稍大,本题难度较小。
正确答案
CH3OCH3-12e-+ 16OH-=2CO32-+11H2O(2分)
c(K+)>c (HCO3-)>c (CO32-)>c (OH-)>c( H+ ) (1分)
解析
由题意可知:
n(O2)=6.72/22.4 mol =0.3mol n(KOH)=0.3mol
n(e-)=4n(O2)=1.2mol 根据电子得失守恒:
n(CO2)=0.2mol
2KOH+ CO2= K 2 CO+ H 2 O
0.3 0.15 0.15
K 2 CO3+ H 2 O+ CO2=2KHCO3
0.05 0.05 0.1
即最终为n(K 2 CO3)=n(KHCO3)
碳酸钠水解程度大于碳酸氢钠,故得到答案结果。
考查方向
本题考查了燃料电池电极反应式书写、离子浓度大小的比较、计算等知识点。
解题思路
CH3OCH3-12e-+ 16OH-=2CO32-+11H2O
解题步骤:负极二甲醚放电,溶液呈碱性,碳元素的存在形态为CO32-,分析碳元素化合价,写出失去电子数,在根据电荷守恒配平OH-,根据原子守恒配平H2O
燃料电池都可以用这个模式来解题。
第二空见解析。
教师点评
本题考查了燃料电池电极反应式书写、离子浓度大小的比较、计算等知识点。难度较大,考查学生综合能力,在高考中出现频率中等。
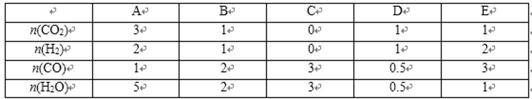
10. 等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达平衡:
X(g)+Y(g)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述中正确的是 ( )
①生成物的质量分数一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂
正确答案
解析
解析已在路上飞奔,马上就到!
知识点


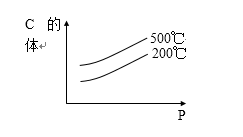
当达到平衡时生成物C的体积分数与温度和压强
p的关系如图所示,则下列说法中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.某校化学实验小组同学进行有关NO2气体的系列实验。
(1)如右图所示,烧瓶中放有少量铜片,打开分液漏斗的旋塞,加入过量浓硝酸,烧瓶中产生气体的颜色是 ( ),用化学方程式表示其原因( );
(2)将烧瓶浸入冰水中,烧瓶内气体颜色( )(填“变深”、“不变”或“变浅”),使用化学用语和必要的文字说明颜色变化的原因( );
(3)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:

②平衡后,向该容器中再充入0.2molN2O4气体,则N2O4的转化率 (填增大、减小或不变)
③改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号)( )
A.增大N2O4的起始浓度
B.升高温度
C.使用高效催化剂
D.向混合气体中通入稀有气体
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.(1)已知pH =2的高碘酸(
已知


(2)体积不变的密闭容器内部有一不漏气且可滑动的话塞将容器分成左右两个室,左室内充入一定体积的CO和H2O气体,右室充人SO2和O2两种气体共4mol,且SO2和O2的物质的量之比为2:1,左右两室内各可发生如下反应:
反应开始时活塞停留在离左端点
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.反应物和生成物均为气态的平衡体系,平衡常数表达式为:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析