- 化学平衡状态的判断
- 共46题
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率___ mol/(L·min);该反应的平衡常数表达式K=_____
(2)上述反应达到平衡后,下列说法正确的是_。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是__。
a.3v逆(N2)=v正(H2)
b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变
d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为

正确答案
(1) 0.02 、 
(2)bd
(3)ac ;
(4)<
解析
本题考查化学反应速率与化学平衡,意在考查考生的思维能力和分析、推断能力。
(1)由方程式可知固体(Si3N4)质量增加2.80g时消耗n(H2)=2.80g/140g·mol-1×6=0.12mol,故v(H2)=0.12mol/(2L·3min)=0.02mol/(L·min);利用反应方程式可直接写出反应的平衡常数表达式。
(2)因反应为放热反应,故反应达到平衡后,升高温度,平衡逆向移动,平衡常数K减小,b正确、温度不变,加压或改变反应物的浓度等平衡常数不变,a错误、其他条件不变,增加固体Si3N4平衡不移动,c错误、其他条件不变,增大HCl的物质的量,平衡向消耗HCl的逆反应方向移动,d正确。
(3)利用化学反应速率之比等于化学方程式计量系数比可知a项叙述表示v正=v逆,表示反应达到平衡态;b项均表示正反应,无论反应是否处于平衡态,都成立;d项表示的浓度关系与是否平衡无关;混合气体密度不变说明溶液中气体质量不变,而平衡移动则气体质量改变,所以c项表示达到平衡态。
(4)降低温度,平衡正向移动,n(H2)/n(HCl)变小。
知识点
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42-


其中第①步存在平衡:2CrO42-(黄色)+2H+
(1)若平衡体系的pH=2,该溶液显_______色。
(2)能说明第①步反应达平衡状态的是_______。
a. 222Cr2O72-和222CrO42-的浓度相同
b.2v (Cr2O72-)=v (CrO42-)
c.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要_______mol的FeSO4
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) 
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH―)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至_______。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生222Cr(OH)3沉淀。
(5)用Fe做电极的原因为_______。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)_______,溶液中同时生成的沉淀还有_______。
正确答案
(1)橙
(2)c
(3)6
(4)5
(5)阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+
(6)2H++2e-=H2↑;Fe(OH)3
解析
(1) c (H+)增大,平衡2CrO42-(黄色)+2H+
(2)Cr2O72-和CrO42-的浓度相同时,并不能说明各组分的浓度不再改变了,故a不能说明反应已达平衡状态;v(Cr2O72-)和v(CrO42-)可表示正反应或逆反应,2v(Cr2O72-)=v (CrO42-)意义不明,不能说明正逆反应速率相等;溶液的颜色不再改变,也就是各物质的浓度不再改变,是平衡状态,故选c;
(3)还原1 molCr2O72-离子生成2 mol Cr3+,得到的电子数为6 mol,根据电子得失守恒可知,需要6 mol的FeSO4
(4)当c(Cr3+)=10-5 mol/L时,溶液的c(OH―)=
(5)在电解法除铬中,铁作阳极,铁优先失去电子生成Fe2+,以提供还原剂;
(6)在阴极附近溶液pH升高的原因是H+放电生成H2的同时,降低了溶液的酸性;Fe2+与Cr2O72-反应生成了Fe3+,Fe3+转化为Fe(OH)3沉淀。
知识点
甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)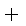
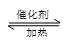
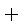
下表所列数据是反应在不同温度下的化学平衡常数(K)。
(1)判断反应达到平衡状态的依据是
A,混合气体的密度不变
B,混合气体的平均相对分子质量不变
C,生成CH3OH的速率与消耗CO的速率相等
D。CH3OH、CO、H2的浓度都不再发生变化
(2)由表中数据判断Q 0 (填“>”、“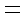
A,加入催化剂 B,充入CO C,充入H2 D,升温
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c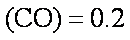
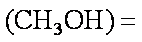
(3)原料CO和H2可以由C和H2O反应制取,涉及的反应方程式如下:
C(s)

C(s)

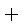
CO(g)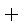

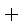
则K1、K2 、K3之间的关系是: 。
正确答案
(1) BD
(2)>、C
(3)0.08 80%
(4) K2=K1·K3
解析
略
知识点
一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:
2A(g)+B(g)
正确答案
解析
略
知识点
在体积恒定的密闭容器中,一定量的SO2与1.100mol O2在催化剂作用下加热到600℃发生反应:

正确答案
解析
本题考查化学反应速率.平衡及计算。SO3的生成速率和SO2的消耗速率都是正反应速率,两者始终相等,不能说明已达平衡,A错;由于正反应是放热的,所以降温时平衡右移,正反应速率大于逆反应速率,即正反应速率较小程度小于逆反应速率,B错;根据化学方程式知:生成的SO3的物质的量是气体总物质的量减小量的2倍,即0.63 mol,SO2不与BaCl2反应,则生成硫酸钡为0.63 mol,得到146.79 g,C错;根据平衡前后的压强比知反应前气体的总物质的量减小0.315 g,即减小1-82.5%=17.5%,所以反应前气体总物质的量为1.8 mol,O2为1.1 mol,则SO2为0.7 mol.消耗的SO2的物质的量等于生成的SO3的物质的量,即0.63 mol,转化率为0.63 mol/0.7 mol=90%,D正确。
知识点
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)
(1)该反应所用的催化剂是______________(填写化合物名称),该反应450℃时的平衡常数_____________500℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)该热化学反应方程式的意义是__________________________________________________
_____________________________________________________________________________。
(3)下列描述中能说明上述反应已达平衡的是________________________
a ,υ(O2)正 = 2υ(SO3)逆
b,容器中气体的平均分子量不随时间而变化
c,容器中气体的密度不随时间而变化
d,容器中气体的分子总数不随时间两变化
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO3 0.18mol,则υ(O2)=____________ mo1/(L·min);若继续通入0.20mol SO2和0.10mol O2,则平衡________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,___________mo1<n(SO3)<___________mol。
正确答案
(1) 五氧化二钒(V2O5) 大于
(2)在450℃时,2molSO2气体和1mol O2气体完全反应生成2molSO3气体时放热190kJ。
(3)b d
(4)0.036 向正反应方向 0.36 0.40
解析
略
知识点
某恒温密闭容器中,可逆反应A(s)
正确答案
解析
略
知识点
已知A(g)+B(g)
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率υ(A)=0。003 mol·L-1·s-1。,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a,压强不随时间改变
b.气体的密度不随时间改变
c. c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应
正确答案
(1)
(2)0.022 mol·L-1 0.09mol 80% 80%
(3)c
(4)2.5
解析
(1)因反应中的物质都是气体,据平衡常数的定义可知其K=
(2)υ(A)=0.003 mol·L-1·s-1 ,则A减少的浓度c(A)= υ(A)t=0.018 mol·L-1,故剩余的A的浓度为
设830℃达平衡时,转化的A的浓度为x,则:
解得x =0.032,故A的转化率

(3)由于该反应是气体分子数不变的反应,容器中压强、气体的密度都永远不变,故a、b错;c(A)随反应的进行要减小,故c可以;不论是否达平衡,单位时间里生成C和D的物质的量永远相等,故d错。
(4)反应“ C(g)+D(g)



知识点
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g)
根据题意完成下列填空:
(1)在地壳深处容易有________气体逸出,在地壳浅处容易有________沉积。
(2)如果上述反应的平衡常数K值变大,该反应________(选填编号)。
a. 一定向正反应方向移动
b. 在平衡移动时正反应速率先增大后减小
c. 一定向逆反应方向移动
d. 在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,________(选填编号)。
a. 2v正(HF)=v逆(H2O)
b. v(H2O)=2v(SiF4)
c. SiO2的质量保持不变
d. 反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为________。
正确答案
(1)SiF4 、H2O;SiO2
(2)ad
(3)bc
(4)0.0010mol(L·min)
解析
本题考察外界条件对化学平衡的影响、化学平衡常数和化学平衡状态的的理解以及反应速率的有关计算。
(1)地壳深处温度低,使得平衡右移,会逸出SiF4、水蒸气气体;浅处温度高平衡左移动,析出SiO2沉淀。
(2)由于反应吸热,平衡常数K值变大,说明温度降低,则平衡正向移动,温度降低后逆反应速率开始要减小,由于平衡右移动,故逆反应速率又会逐渐增大直至到达新的平衡。
(3)平衡时a项v正(HF)= 2v逆(H2O),d项反应继续进行只是转化的生成物与分解的生成物相等。
(4)密度增大了0.12 g/L,说明质量增加了0.24g,即参加反应的SiO2为0.24g,其物质的量为0.004mol,则转化的HF为0.016mol,则HF的反应速率为
知识点
工业上采用乙苯与
其中乙苯在
(1)上述乙苯与

(2)①乙苯与
②下列叙述不能说明乙苯与
a。
c,消耗


(3)在3L密闭容器内,乙苯与




别改变了实验其他条件;乙苯的浓度随时间的变化如图I所示。
①实验I乙苯在0-50min时的反应速率为_______________
②实验Ⅱ可能改变条件的是__________________________
③图II是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线。
(4)若实验I中将乙苯的起始浓度改为
正确答案
(1)
(2)
(每空2分 共4分)
(3)①
②加入催化剂
③
(4)减小(2分);0.225 (2分)
解析
略
知识点
扫码查看完整答案与解析






