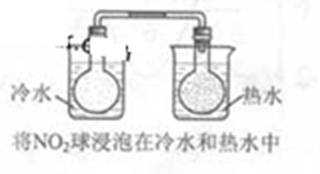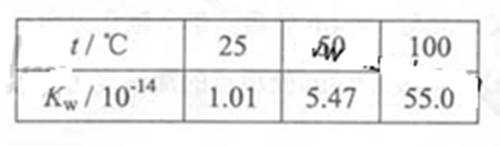- 化学平衡移动原理
- 共39题
下列实验事实不能用平衡移动原理解释的是
正确答案
解析
A、存在平衡 
B、水的电离是可逆过程,升高温度Kw增大,促进水的电离,故B正确;
C、催化剂不能影响平衡移动,故C错误;
D、弱电解质电离存在平衡,浓度越稀,电离程度越大,促进电离,但离子浓度降低,故氨水的浓度越稀,pH值越小,故D正确。
知识点
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)滤渣主要成分有 和 以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因: 。
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液PH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图14,由图可得,随着温度升高,
① ②
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:
已知298K时, Ksp(CaCO3)=2.80×10-9, Ksp(CaSO4)=4.90×10-5 ,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
正确答案
见解析。
解析
(1) Ca(OH)2 Mg(OH)2
(2) 氢氧根与镁离子结合,使平衡向右移动,K+变多
(3) K2CO3 H2SO4
(4) ①在同一时间K+的浸出浓度大。②反应的速率加快,平衡时溶浸时间短。
(5)K=1.75×104
知识点
降低太气中

(1)将燃煤废气中的

①某温度下,将2。0mol
则











②一定条件下,上述反应在密闭容器中达平衡。当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是________。
a. 反应物的浓度降低
b. 容器内压强增大
c. 正反应速率大于逆反应速率
d. 化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,

a.
b.
c. 降低温度,
正确答案
(1) ①>;<;57.14%;② cd
(2)增大;b
(3)2Fe3+ +3CO32-+3H2O=2Fe(OH)3(胶体)+3CO2↑
解析
略。
知识点
光谱研究表明,易溶于水的S02所形成的溶液中存在着下列平衡:
据此,下列判断中正确的是
正确答案
解析
本题主要考察化学平衡状态的特点和外界条件对化学平衡对影响。因为该反应是可逆反应,所以达到平衡后反应物和生成物共同存在与体系中,所以选项A正确;溶液中H+的来源有3个方面,即水的电离、SO2·xH2O和HSO3-的电离,因此溶液中H+浓度不一定是SO32-浓度的2倍,选项B错误;SO2是一种还原性气体,若加入的酸是氧化性酸,SO2将被氧化成硫酸而不会放出SO2气体,选项C错误;NaHSO3是一种酸式盐可以与NaOH反应,方程式为NaHSO3+NaOH=Na2SO3+H2O,选项D也错误。
知识点
30.合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。
在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)==ZMHy(s) △H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=_____(用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=______mL•g-1•min。反应的焓变△HⅠ_____0(填“>”“<”或“=”)。
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)____ η(T2)(填“>”“<”或“=”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的_____点(填“b”“c”或“d”),该贮氢合金可通过______或_______的方式释放氢气。
(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为_________。已知温度为T时:
CH4(g)+2H2O=CO2(g)+4H2(g) △H=+165KJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41KJ•mol
正确答案
(1)2/(y—x);30;<
(2)>;c;加热 减压
(3)CO(g)+3H2(g)=CH4(g)+H2O(g) ∆H=—206kJ•mol‾1
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析