- 等效平衡
- 共15题
我们学过的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,且均符合勒夏特列原理。
一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应
有关物质的量随时间的变化如图所示。
(1)0~2 min内的平均反应速率
平衡常数表达式为
(2),相同温度下,若开始加入
A,平衡常数
B,
C,达到平衡的时间
D,平衡时体系压强
(3)下列措施肯定能使平衡向逆反应方向移动的是的 ( )
A,充入少量氨气
B,降温至0℃
C,充入少量硫化氢
D,加压
(4)常温下,将
① 浓度为
② 
③ 
则a、b、c、d之间由大到小的关系是: 。
(5)常温下,取
表示醋酸溶液中pH变化曲线的是 (填“A”或“B”);设盐酸中加入的Zn质量为



(6)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系的比较正确的是
A,在A、B间任一点,溶液中一定都有
B,在B点,
C,在C点:
D,在D点:
正确答案
(1)0.1mol/(L·min)
(2)BD
(3)A
(4)b>a=d>c
(5)B,<
(6)D
解析
略
知识点
某小组根据工业生产原理设计如下转化关系,以获取烧碱和金属钛(Ti)。
(1) 燃料电池中通入氧气的电极是 (填“正”或“负”)极,电极反应式是 ;用该电池电解饱和食盐水,若消耗32 g甲醇,理论上Ⅰ中可生成NaOH ________mol。
(2)如图所示,理论上加入Ⅱ中的TiO2和焦炭的物质的量之比是 ;由TiCl4得到金属Ti的化学方程式是 。
(3)根据Ⅲ中合成甲醇的反应,该小组保持温度不变,在两个相同的恒容密闭容器中进行实验,有关实验数据如下:
① P1 4MPa(填“>”、“<”或“=”);
② 实验Ⅰ条件下合成甲醇的热化学方程式是 。
正确答案
见解析。
解析
(1)正 
(2)1﹕2
(3)①<
②
知识点
已知2SO2(g)+ O2(g)

正确答案
解析
略
知识点
在温度、容积相同的3个密闭容器中,按不同方式

下列说法正确的是
正确答案
解析
略
知识点
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) 
正确答案
解析
本题属于基本理论中化学平衡问题,主要考查学生对速率概念与计算,平衡常数概念与计算,平衡移动等有关内容理解和掌握程度。高三复习要让学生深刻理解一些基本概念的内涵和外延。A:反应在t1min内的平均速率应该是t1min内H2浓度变化与t1的比值,而不是H2物质的量的变化与t1的比值。B:因为反应前后物质的量保持不变,保持其他条件不变,平衡常数不会改变,起始时向容器中充入议0.60molCO和1.20 molH2O,似乎与起始时向容器中充入0.60molH2O和1.20 molCO效果是一致的,到达平衡时,n(CO2)=0.40 mol。C:保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大。D:原平衡常数可通过三段式列式计算(注意浓度代入)结果为1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应。
知识点
一定条件下存在反应:CO(g)+H2O(g)
正确答案
解析
略
知识点
10.已知工业生产硫酸过程中,2SO2(g) + O2(g)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) 
(1)不同温度下的平衡转化率与压强的关系如图所示。
① 该反应ΔH________(填“>”或“<”,下同)0,ΔS________0,则该反应________(填“一定能”“一定不能”或“不一定”)自发进行。
② 实际生产条件控制在250℃、1.3×l04kPa左右,选择此压强的理由是( )。
(2)某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.1mol/L。
① 该反应的平衡常数K=( )。
② 在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是( )(填字母)。
a. 氢气的浓度减少
b. 正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加
d. 重新平衡时,n(H2)/n(CH3OH)增大
③ 若保持同一反应温度将起始物质改为amol CO、bmol H2、cmol CH3OH,欲使平衡混合物中各组成与原平衡相同,则a、b应满足的关系为____________________,且欲使开始时该反应向逆反应方向进行,c的取值范围是( )。
正确答案
(1)①<<不一定②该压强下,CO转化率已较高(90%左右),再增大压强,CO转化率提高不大,且生产成本增加
(2)① 6.25 ② bc ③ a+c=2和b+2c=6或b=2+2a1.8<c≤2
解析
解析已在路上飞奔,马上就到!
知识点
26.在一个固定体积的密闭容器中,向容器中充入2 mol A 和1 mol B,发生如下反应:2A(g) + B(g) 
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为( ) (填“吸热”或“放热”)反应.
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是( ) (用序号填空).
①4 mol A+2 mol B ②3 mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
(3)某温度下,向容器中加入3 mol C和0.8 mol D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于( )L,小于( )L.
正确答案
(1)吸热
(2)③
(3)0.52.5
解析
解析已在路上飞奔,马上就到!
知识点
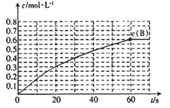
27. 298K时,某容积固定为1L的密闭容器中发生如下可逆反应:A(g)
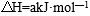
回答下列问题:
(1)前60s内A的平均反应速率为( )mol/(L·s)。
(2)若B的平衡浓度为A的3倍,则A的转化率为( ),在70s时再向容器中通入一定量的A气体,再次达到平衡时A的转化率将( )(选填“不变”或“变大”或“变小”)。
(3)其他条件不变,反应在323K进行,B的平衡浓度为A的2倍,且达到平衡所需时间为298K时的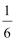
①该反应的△H ( ) 0(填“>”或“<”)
②请在图中画出323K时A的物质的量浓度随时间的变化曲线。
(4)若反应在298K进行,在2L密闭容器中加入1molB、0.2molNe,达到平衡B的转化率为( ) 。
a.等于60%
b.等于40%
c.小于40%
d.介于40%—60%之间
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析