- 化学反应速率与化学平衡图象的综合应用
- 共80题
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)
正确答案
解析
图像为从反应开始以后正反应速率的变化曲线,c点正反应速率达到最大值后开始减小,一定未达平衡,速率变化的过程不是平衡状态,A错;a点到b点正反应速率增加,反应物浓度随时间不断减小,反应物浓度:a点大于b点,B错;从a点到c点,为什么反应物的浓度是减小的,而速率在增加,因为该容器是绝热恒容密闭容器,只有反应是放热的,放出的热量在绝热容器中使反应物的温度升高,温度对反应速率的影响程度大,反应速率加快;c点后反应仍放热,但此时浓度减小对反应速率的影响增大,正反应速率随反应物浓度的减小而减小;依次反应是放热的,反应物的总能量高于生成物的总能量,则C错;a-b段的反应速率小于b-c段的,故相等的时间内,b-c段转化的SO2多,故D正确。
知识点
化合物


(1)已知




(2)反应


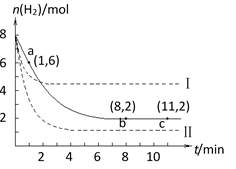
①列式计算实验a从反应开始至达到平衡时的反应速率 v(
②图中3组实验从反应开始至达到平衡时的反应速率v(
③用

正确答案
(1)
(2)①
②bca;加入催化剂。反应速率加快,但平衡点没有改变;温度升高。反应速率加快,但平衡点向逆反应方向移动(或反应容器的溶剂和起始物质的量未改变,但起始总压强增大)
③
解析
略。
知识点
在密闭容器中发生反应:X+3Y
正确答案
解析
略
知识点
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
①Ni(S)+4CO(g)

完成下列填空:
(1)在温度不变的情况下,要提高反应(1)中Ni(CO4)的产率,可采取的措施有 、 。
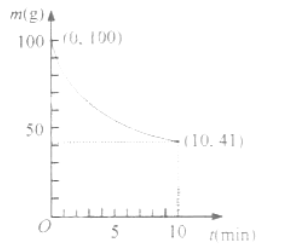
(2)已知在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如下图所示。Ni(CO)4在0~10min的平均反应速率为 。
(3)若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 。
A.平衡常数K增大
B.CO的浓度减小
C.Ni的质量减小
D.v逆[Ni(CO)4]增大
(4)简述羰基法提纯粗镍的操作过程。
正确答案
(1)增大CO浓度,加压。
(2)0.05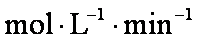
(3)bc。
(4)把粗镍和CO放于一个水平放置的密闭的玻璃容器中,然后在低温下反应,一段时间后在容器的一端加热。
解析
(1)反应(1)是正向气体体积缩小的放热反应,因此,根据平衡移动原理在温度不变的情况下采取可增大CO浓度,加压的方法提高产率;
(2)根据题意,反应的Ni为1mol,则生成

(3)反应(2)正向气体体积增大的吸热反应,降低温度平衡逆向移动,平衡常数K、CO的浓度、Ni的质量、v逆[
(4)根据反应①②的特点可提纯粗镍。
知识点
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷.氧气和水蒸气,发生的主要化学反应有:
回答下列问题:
(1)反应CO(g)+H2O(g)
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于.小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则反应CH4(g)+H2O(g)
随着温度的升高,该平衡常数 (填“增大”.“减小”或“不变”)。
(4)从能量阶段分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度.压强对H2和CO物质的量分数的影响如下图:
①若要达到H2物质的量分数>65%.CO的物质的量分数<10%,以下条件中最合适的是 。
(a)600℃,0.9Mpa
(b)700℃,0.9MPa
(c)800℃,1.5Mpa
(d)1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)
的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
正确答案
见解析。
解析
(1)根据盖斯定律,由蒸汽重整的两个反应不难得出该反应的△H=-41.2kJ/mol
(2)由于甲烷氧化的活化能低于蒸汽重整的活化能,所以蒸汽重整速率小于甲烷氧化速率。
(3)Kp=
(4)由于放热的甲烷氧化产生的热量可以供给吸热的蒸汽重整,提高了能源的利用率。
(5)简单读图,条件B同时符合“H2物质的量分数>65%.CO的物质的量分数<10%”;
作图的关键是找准零时刻起点位置,反应过程中的变化趋势以及平衡以后的终点位置,氢气不是原料气,即开始时刻氢气含量为0,由图中可以读出600℃,0.1Mpa条件下,平衡系统中H2物质的量分数为70%,因此不难作图如下:
(6)甲烷氧化程度过高,氢气会和氧气反应。
知识点
在一定条件下,N2O分解的部分实验数据如下:
下图能正确表示该反应有关物理量变化规律的是
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
正确答案
解析
略
知识点
在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如题7图所示。下列叙述正确的是( )
正确答案
解析
略
知识点
T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g) 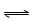
正确答案
解析
略
知识点
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)
回答下列问题:
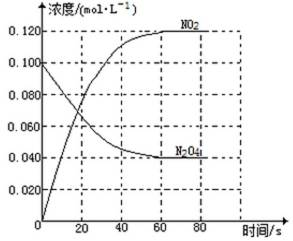
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②列式计算温度T是反应的平衡常数K2
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
正确答案
(1)① 大于 ② 0.0010 ③0.36mol·L-1
(2)a:④大于
⑤ 反应正方向吸热,反应向吸热方向进行,故温度升高
b:⑥平衡时,c(NO2)= 0.120mol·L-1 +0.0020mol·L-1·S-2×10s×2=0.16mol·L-1
c(N2O4)=0.040 mol·L-1-0.0020 mol·L-4×10s=0.020 mol·L-1
K2= 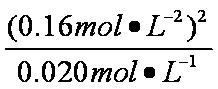
(3)逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动
解析
略
知识点
工业上采用乙苯与
其中乙苯在
(1)上述乙苯与

(2)①乙苯与
②下列叙述不能说明乙苯与
a。
c,消耗


(3)在3L密闭容器内,乙苯与




别改变了实验其他条件;乙苯的浓度随时间的变化如图I所示。
①实验I乙苯在0-50min时的反应速率为_______________
②实验Ⅱ可能改变条件的是__________________________
③图II是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线。
(4)若实验I中将乙苯的起始浓度改为
正确答案
(1)
(2)
(每空2分 共4分)
(3)①
②加入催化剂
③
(4)减小(2分);0.225 (2分)
解析
略
知识点
扫码查看完整答案与解析