- 电解质溶液
- 共721题
氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义。
15.NO可通过氧化-还原法转化为N2,转化关系如下:
反应Ⅰ的化学方程式是_______;反应Ⅱ的还原剂是_______。
16.NO还可与C在一定条件下反应得到无污染的气体。NO与C在一定条件下反应的化学方程式是_______。
17.NO也可直接用活性铁粉转化为N2。
已知:N2(g)+O2(g)=2NO(g) △H1 4Fe(s)+3O2(g)=2Fe2O3(s) △H2
则6NO(g)+4Fe(s)=2Fe2O3(s)+3N2(g) △H =_______(用“△H1”、“△H2”表示)。
18.NO2可电解制备绿色硝化试剂N2O5。下图是其原理示意图。

正确答案
2NO +O2=2NO2 CO(NH2)2
解析
NO与氧气反应生成NO2,方程式为2NO+O2=2NO2,NO2具有氧化性,CO(NH2)2与发生氧化还原反应生成氮气CO(NH2)2为还原剂,故答案为:2NO+O2=2NO2;CO(NH2)2
考查方向
本题考查了氧化剂与还原剂的知识点
解题思路
NO与氧气反应生成NO2,NO2具有氧化性,CO(NH2)2与发生氧化还原反应生成氮气
易错点
易错点是混淆还原剂的概念。还原剂具有还原性,本身被氧化,组成的某种元素的化合价由低到高。
教师点评
本题考查了氧化剂与还原剂的知识点,在近几年的各省高考题出现的频率非常高。
正确答案
解析
NO还可与C在一定条件下反应得到无污染的气体,应生成氮气和二氧化碳,方程式为2NO+C═N2+CO2,故答案为:2NO+C═N2+CO2
考查方向
本题考查了书写化学方程式的能力
解题思路
NO还可与C在一定条件下反应得到无污染的气体,应生成氮气和二氧化碳
易错点
注意反应的条件不要漏写。
教师点评
本题考查了书写化学方程式 的能力,在近几年的各省高考题出现的频率非常高。
正确答案
△H2-3△H1
解析
已知①N2(g)+O2(g)=2NO(g)△H1②4Fe(s)+3O2(g)=2Fe2O3(s)△H2,利用盖斯定律将②-①×3可得6NO(g)+4Fe(s)=2Fe2O3(s)+3N2(g),则△H=△H2-3△H1,故答案为:△H2-3△H1
考查方向
本题考查了有关热化学方程式的知识
解题思路
已知①N2(g)+O2(g)=2NO(g)△H1②4Fe(s)+3O2(g)=2Fe2O3(s)△H2,利用盖斯定律将②-①×3可得6NO(g)+4Fe(s)=2Fe2O3(s)+3N2(g)
易错点
注意盖斯定律的应用
教师点评
本题考查了有关热化学方程式的知识,在近几年的各省高考题出现的频率非常高。
正确答案
① 2NO2(g) 
给1分)③ N2O4(也可写成NO2)
解析
①2NO2(g)⇌N2O4(g)△H<0,降低温度向吸热方向移动,即降低温度向生成N2O4的方向移动,
故答案为:2NO2(g)⇌N2O4(g)△H<0,在其他条件不变时,降温平衡右移,有利于NO2转化为N2O4;
②NO2可电解制备绿色硝化试剂N2O5,N元素化合价升高,NO2被氧化,电极方程式为N2O4-2e-+2HNO3=2N2O5+2H+,故答案为:N2O4-2e-+2HNO3=2N2O5+2H+;
③阳极上N2O4放电生成N2O5,电极反应为N2O4-2e-+2HNO3=2N2O5+2H+,阴极发生2NO3-+2e-+4H+=N2O4+2H2O,则循环使用的物质为N2O4,
故答案为:N2O4
考查方向
本题考查了电解池和化学反应平衡的知识
解题思路
NO2可电解制备绿色硝化试剂N2O5.N元素化合价升高,NO2被氧化,为电解池阳极反应,阴极浓硝酸被还原生成N2O4
易错点
注意电极方程式的书写。
教师点评
本题考查了电解池和化学反应平衡的知识,在近几年的各省高考题出现的频率非常高。
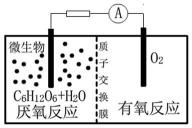
12.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
正确答案
解析
燃料电池中O2得电子在正极反应, C6H12O6失电子在负极上反应
A.通过原电池的电极反应可知,负极区产生了H+,根据原电池中阳离子向正极移动,可知质子(H+)通过交换膜从负极区移向正极区,故A正确;
B.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池,有电流产生,所以微生物促进了反应中电子的转移,故B正确;
C.根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极的电极反应式为O2+4e-+4H+═2H2O,因此CO2在负极产生,故C错误;
D.该反应属于燃料电池,燃料电池的电池反应式和燃烧反应式相同,则电池反应式为C6H12O6+6O2=6CO2+6H2O,故D正确;
考查方向
本题考查原电池原理
解题思路
燃料电池中O2得电子在正极反应, C6H12O6失电子在负极上反应:
A.原电池中,阳离子向正极移动,所以质子通过交换膜从负极区移向正极区;
B.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池;
C.根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极的电极反应式为O2+4e-+4H+═2H2O;
D.燃料电池反应式和燃料燃烧方程式相同
易错点
电极反应式,根据氧化还原中的得失电子分析
教师点评
本题考查原电池原理,在近几年的各省高考题中出现的频率非常高
知识点
下列有关说法正确的是( )
正确答案
解析
铜比铁稳定,应附着比铁活泼的锌,A错误;反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的体积减小,若在常温下能自发进行,则该反应的△H<0;B 错误;水解是吸热反应,所以C正确;D选项速率增大,平衡常数减小,错误。
知识点
室温时,M(OH)2(S) 
正确答案
解析
考察沉淀溶解平衡与PH值的关系。C(M2+)·C2(OH-)= a ;C2(OH-)=a/b,经过计算。
知识点
实验:① 0.1 mol·L-1 MgCl2溶液和0.2 mol·L-1NaOH溶液等体积混合得到浊液a,取少量浊液a过滤得到滤液b和白色沉淀c;
② 向浊液a中滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀。
下列分析不正确的是
正确答案
解析
略
知识点
16. 室温下,甲、乙两烧杯均盛有5mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4,关于甲、乙两烧杯中溶液的描述正确的是( )
正确答案
解析
略
知识点
25 ℃在等体积的①pH=0的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液,③pH = 10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
正确答案
解析
①中pH=0的H2SO4中c(H+)=1.0 mol·L-1,c(OH-)=1.0×10-14mol·L-1,水电离程度为1.0×10-14mol·L-1。②中c(OH-)=0.1 mol·L-1,c(H+)=1.0×10-13mol·L-1,水电离程度为1.0×10-13mol·L-1。③中c(OH-)=1.0×10-4mol·L-1,水的电离程度为1.0×10-4mol·L-1。④中c(H+)=1.0×10-5mol·L-1,水的电离程度为1.0×10-5mol·L-1。故①②③④中水的电离程度之比为:1.0×10-14mol·L-1:1.0×10-13mol·L-1:1.0×10-4mol·L-1:1.0×10-5mol·L-1=1:10:1010:109,A项正确。
知识点
一定温度下,下列溶液的离子浓度关系式正确的是
正确答案
解析
略
知识点
常温下0.1mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
正确答案
解析
醋酸是弱酸,稀释10倍,pH增加不到一个单位,A项错误,加入适量的醋酸钠固体,抑制醋酸的电离,使其pH增大,可以使其pH由a变成(a+1);B项正确。
加入等体积0.2 mol·L-1盐酸,虽然抑制醋酸的电离,但增大了c(H+),溶液的pH减少;C项错误。提高溶液的温度,促进了醋酸的电离,c(H+)增大,溶液的pH减少;D项错误。
此题涉及弱电解质的电离平衡移动,切入点都是比较常规的设问,但学生易错选。
知识点
13.已知25℃时,
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析