- 电解质溶液
- 共721题
7.电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是( )
正确答案
解析
A石墨电极为正极,发生还原反应错误
B乙醇难电离,产生的离子浓度太低,不能增强导电性
C负极产生的CO2作为正极氧化物循环使用
D正极O2做氧化剂,O2+2CO2 +4e-=2CO3 2-错误。
考查方向
解题思路
根据题目相关信息判断反应发生情况。
易错点
电极反应
知识点
11.一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示。下列说法错误的是( )
正确答案
解析
由图分析可知,通入a电极的为BH4-其中的B失电子化合价降低生成BO2-,因此a为电池的负极。b为电池的正极,H2O2中O由-1价降到-2价发生还原反应,反应式为:H2O2+2e-=2OH-,A正确。原电池工作时,电解质溶液中的阳离子由负极区向正极区移动,B正确。电子由负极流出,正极流入,即a→b,故C错误。正极区产生的氢氧根,可以经处理后输入a极室循环使用,D正确。
考查方向
解题思路
先判断出原电池的正负极,结合两极的材料与电解质环境,再掌握两极的反应书写。
易错点
原电池工作原理
知识点
铜及其化合物在工业上有许多用途。回答下列问题:
12.某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
①浸取反应中氧化剂的化学式为 ;
滤渣Ⅰ的成分为MnO2和 __ (写化学式)
②“除铁”这一步反应在25℃进行,加入的试剂A为__________
若加A后溶液的PH调为4,溶液中Fe3+离子浓度为 mol/L。
(已知Ksp[Fe(OH)3]= 4.0×10-38)
③“沉锰”(除Mn2+)过程中反应的离子方程式 。
④ 滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
13.某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
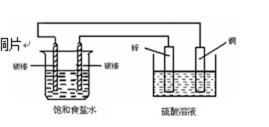
①下图1为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前电极质量相等,一段时间后,两电极质量相差25.8g,则导线中通过了_____ mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则乙池电解质溶液的质量与实验前的电解质溶液的质量差△m= g
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如图2所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH_______(填“减小”、“增大”或“不变”) ,乙池中石墨为_______极(填“正”、“负”、“阴”或“阳”)
正确答案
①MnO2S、SiO2; ②4.0×10-8
③Mn2+ +HCO3-+NH3 = MnCO3↓+ NH4+; ④(NH4)2SO4
解析
:①由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,反应中Mn元素化合价降低,被还原,MnO2为氧化剂,因二氧化硅与酸不反应,则滤渣Ⅰ的成分为MnO2、S和SiO2,故答案为:MnO2;SiO2;
②溶液pH=4,c(OH-)=10-10mol/L,则稀释后的溶液中铜离子浓度最大不能超过:
考查方向
解题思路
辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液PH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜,
①由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,根据方程式判断;②根据Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,根据OH-离子的浓度计算Cu2+离子的浓度;③“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,以此可书写反应的离子方程式;④滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体;
易错点
物质分离提纯的方法、流程分析及应用、电解池工作原理
正确答案
①0.4; 2.8 ②增大; 阴
解析
:①图2为原电池反应,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差6g,
则 Fe+Cu2+═Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
6g n
则:n=0.1mol,转移电子的物质的量为0.1mol;
甲池中溶解铁的质量为:

考查方向
解题思路
辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液PH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜,
①图2为原电池反应,Fe为负极,发生反应:Fe-2e-=Fe2-,石墨为正极,发生反应Cu2++2e-=Cu;根据甲乙两池得失电子相等计算甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量差;②根他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置是电解池,甲装置是原电池
易错点
物质分离提纯的方法、流程分析及应用、电解池工作原理
6.常温下,下列各组离子在指定溶液中一定能大量共存的是()
正确答案
解析
A、能溶解Al(OH)3的溶液,即有可能是酸性也有可能是碱性,均不能与HCO3-
共存,错误;B、铝离子与碳酸氢根离双水解,不能共存,错误 ; C、25℃时,水电离出的c(H+)=1×l0-l3 mol/L的溶液中,溶液呈酸性或碱性,在酸性条件下,S2-不能共存,错误; D、正确
考查方向
解题思路
注意审题,离子共存问题条件很重要
易错点
审题不清
知识点
12.向溶液中分别通入足量的相应气体后,下列各组离子还能大量存在的是( )
正确答案
解析
A .酸性条件下H+会与SiO32-反应生成HSiO3 沉淀;
B.NH4+与SO32- 发生双水解;
C.乙烯会与MnO4- 发生氧化还原反应生成新物质;
D.将氨气通入产生OH- 而原溶液成弱碱性无反应发生,则D正确。
考查方向
解题思路
离子不能共存的原因:生成沉淀.气体.弱酸弱碱.氧化还原
易错点
忽略一些反应的发生
知识点
18. LiFePO4用于锂离子二次电池的电极材料,可由LiI和FePO4制备。
(1)FePO4难溶于水,制备方法如下:
Ⅰ.用稍过量的稀H2SO4溶解废铁屑,加热,搅拌,过滤;
Ⅱ.向滤液中加入一定量的H2O2;
Ⅲ.向含Fe3+的溶液加入Na2HPO4溶液,过滤后经进一步处理得FePO4。
①Ⅰ中反应进行完全的现象是 。
② 用离子方程式说明H2O2的作用是 。
③ 已知:H2PO -4 

产生FePO4的离子方
④ Na2HPO4溶液显碱性的原因是 。
(2)制备LiFePO4:将FePO4与LiI混合,在惰性气氛中加热,制得LiFePO4 。
化合物LiI中碘离子的作用是 。

池反应为: FePO4(s) +Li(s) LiFePO4(s) ,装置如下:
①该电池不能用电解质水溶液,原因是 。
②充电时,b极的电极反应式是 。
正确答案
(1)① 不再产生气泡 (2 分)
② 2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O (2 分)
③ Fe3+ + 2HPO42- = FePO4↓+ H2PO4- (2 分)
④ 由于HPO42-可以电离:HPO42- 
H2PO4- + OH-,且水解程度大于电离程度,所以溶液溶解显碱性。(2 分)
(2)作还原剂 (1 分)
(3)① 金属Li可与水发生反应(或2Li + 2H2O =2LiOH + H2↑)(1 分)
② LiFePO4 - e- = Li+ + FePO4 
知识点
16. 甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1 mol/L乙溶液中c(H+)>0.1 mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是
正确答案
解析
根据②中的信息:0.1mol/L乙溶液中c(H+)>0.1mol/L,说明乙是硫酸可知乙是二元酸,故乙是H2SO4;所以B正确;根据③中现象,可以推知丙中含有Cl-;再结合①中提供信息,甲与其它三种物质混合均产生白色沉淀,可以形成白色沉淀的只有BaSO4、BaCO3、Mg(OH)2,因此可推出甲是Ba(OH)2,故A正确;乙是H2SO4,丙是MgCl2,丁是NH4HCO3,故D正确,C错误;
考查方向
离子反应
解题思路
将甲溶液分别与其他三种物质的溶液混合,可以形成白色沉淀的只有BaSO4、BaCO3、Mg(OH)2,因此甲只能是Ba(OH)2;0.1mol/L乙溶液中c(H+)>0.1mol/L,说明乙是硫酸;向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成,说明丙是MgCl2,所以丁是NH4HCO3
易错点
离子相互之间不能共存
教师点评
本题为离子反应推断题,做题时注意题中的反应现象,找出突破口,抓住物质的性质是关键
知识点
4. 电化学半导体CO气体传感器可用于监测环境中CO的含量,其工作原理示意图如下。下列说法不正确的是( )
正确答案
解析
A.O2在对电极上得到电子发生还原反应。
B.由正极 O2+4e-+4H+=== 2H2O可见溶液中H+向对电极移动
C.得失电子总量守恒,O2得4e-CO失2e-反应消耗的CO与O2的物质的量之比为2∶1
D.负极的电极反应式为CO-2e-+2OH-=CO2+H2O
考查方向
解题思路
该电池的电极反应式为
正极: O2+4e-+4H+=== 2H2O(对电极)
负极: CO-2e-+H2O =CO2+2H+(工作电极)
易错点
。
知识点
10. 关于右图装置中的变化叙述错误的是
正确答案
解析
右边装置能自发的进行氧化还原反应,所以右边装置是原电池,锌易失电子而作负极,铜作正极;左边装置连接外加电源,所以是电解池,连接锌棒的电极是阴极,连接铜棒的电极是阳极,
A.电子从负极锌沿导线流向右侧碳棒,再从左侧碳棒流回正极铜片,故A正确;
B.锌片上失电子发生氧化反应,铜片上发生还原反应,故B错误;
C.左侧碳棒是电解池阳极,阳极上应该是氯离子放电生成氯气,右侧碳棒是阴极,该电极上发生的反应:2H++2e-→H2↑,故C正确;
D.铜电极是正极,正极上氢离子得电子析出氢气,故D正确;
考查方向
原电池和电解池的工作原理
解题思路
右边装置能自发的进行氧化还原反应,所以右边装置是原电池,锌易失电子而作负极,铜作正极;左边装置连接外加电源,所以是电解池,连接锌棒的电极是阴极,连接铜棒的电极是阳极,再结合原电池和电解池原理解答
易错点
原电池装置的判断;电子不进入电解质溶液
教师点评
本题主要考查原电池和电解池原理,正确判断原电池和电解池是解本题关键,难度不大。
知识点
19.能正确表示下列反应的离子反应方程式为
正确答案
解析
A、由于浓KOH溶液过量,所以NH4HCO3溶液中的NH4+、HCO3-完全反应,没有加热生成一水合氨,故化学方程式:NH4HCO3 +2KOH=K2CO3+NH3•H2O+H2O,NH4HCO3 、KOH 和 K2CO3均可以拆,故离子方程式为:NH4++HCO3-+2OH-═CO32-+NH3•H2O+H2O,故A正确;
B、明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全,得出明矾和Ba(OH)2的比例为1:2,故离子方程式为Al3++2SO42-+2Ba2++4OH-═AlO2-↓+BaSO4↓+2H2O,故B错误;
C、向FeBr2溶液中通入足量氯气后,Fe2+和Br-均被完全氧化,故化学方程式:2FeBr2 +3Cl2 =2FeCl3 +2Br2,故离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C正确;
D、醋酸是弱酸,不能拆,故离子方程式为:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O,故D错误
考查方向
离子方程式正误判断
解题思路
A、由于浓KOH溶液过量,所以NH4HCO3溶液中的NH4+、HCO3-完全反应,没有加热生成一水合氨;
B、明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全,得出明矾和Ba(OH)2的比例为1:2;
C、向FeBr2溶液中通入足量氯气后,Fe2+和Br-均被完全氧化;
D、醋酸是弱酸,不能拆;
易错点
A项中因没有加热要写成NH3•H2O
教师点评
本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意离子反应中保留化学式的物质,题目难度不大
知识点
扫码查看完整答案与解析