- 指数与指数函数
- 共570题
请你谈一谈对“不同生产方式以及生产工艺中,生产物流管理所采用的方法和手段是不同的。”这句话的理解。
正确答案
测试
如果音叉发出的声波可以用函数
正确答案
210
解析
略
知识点
已知函数


(1)求k的值;
(2)求
(3)设



正确答案
见解析。
解析
(1)
由已知,

(2)由(1)知,
设



由



当


综上可知,


(3)由(2)可知,当




当



设


当



所以当


所以
综上,对任意

知识点
若直线与直线


正确答案
1
解析
略
知识点
角



正确答案
解析
略
知识点
某河流上的一座水力发电站,每年六月份的发电量Y(单位:万千瓦时)与该河上游在六月份的降雨量X(单位:毫米)有关,据统计,当X=70时,Y=460;X每增加10,Y增加5;已知近20年X的值为:140,110,160,70,200,160,140,160,220,200,110,160,160,200,140,110,160,220,140,160。
(1)完成如下的频率分布表:
(2)假定今年六月份的降雨量与近20年六月份的降雨量的分布规律相同,并将频率视为概率,求今年六月份该水力发电站的发电量低于490(万千瓦时)或超过530(万千瓦时)的概率。
正确答案
见解析
解析
(1)在所给数据中,降雨量为110毫米的有3个,为160毫米的有7个,为200毫米的有3个,故近20年六月份降雨量频率分布表为
(2)
故今年六月份该水力发电站的发电量低于490(万千瓦时)或超过530(万千瓦时)的概率为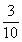
知识点
在


正确答案
解析
略
知识点
数列
(1)求

(2)设

正确答案
见解析。
解析
(1)

一般
得


所以

得
所以数列

综上可知:
(2)
=
=
知识点
已知: 


(1)若点


(2)设函数

正确答案
(1)
解析
(1)由已知可得

所以

(2)

因为


故


知识点
已知:
①25℃时弱电解质电离平衡数:Ka(CH3COOH)=
②25℃时,
请根据以下信息回答下旬问题: 图2
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka
(3)

正确答案
见解析
解析
①HSCN比CH3COOH易电离,CaF2难溶。②F-PH=6,PH=0时以HF存在。
F-与HF总量不变。
问题引导分析(解题分析与答案):
(1)相同的起始条件,只能是因为两种酸的电离度不同导致溶液中起始反应时H+
浓度不同引起反应速率的不同。反应结束后,溶质为CH3COONa和NaSCN,因CH3COOH酸性弱于HSCN,故CH3COONa水解程度大,c(CH3COO-)<c(SCN-)。
(2)HF电离平衡常数Ka= 【c(H+)* c(F-)】/ c(HF),其中c(H+)、 c(F-)、 c(HF)都是电离达到平衡时的浓度,选择中间段图像求解。根据图像:PH=4时,c(H+)=10-4, c(F-)=1.6×10-3、 c(HF)=4.0×10-4。Ka=0.4×10-3。
(3)PH=4.0,则c(H+)=10-4,此时:根据HF电离,产生的c(F-)=1.6×10-3,而溶
液中的c(Ca2+)=2.0×10-4。c2(F-)×c(Ca2+)=5.12×10-10,5.12×10-10大于Kap(CaF2)=
知识点
扫码查看完整答案与解析