- 化学基本概念和基本理论
- 共1765题
9.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子;Y元素原子的M电子层上的电子数是它K层和L层电子总数的一半;Z元素原子的L电子电子数比Y元素原子的L电子层上电子数少2个.则这三种元素所组成的化合物的化学式不可能是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26. X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(水及部分产物已略去)。
(1)若X为金属单质,W是某强酸的稀溶液。X与过量W反应生成Y的离子方程式为_________向Z溶液中加入某种试剂_______(填试剂名称或化学式),若出现蓝色沉淀,即可判断Z溶液中阳离子的存在。
(2)若X为非金属单质,W是空气的主要成分之一。它们之间转化的能量变化如图A所示,则X+W→Z的热化学方程式为_______。
(3)若X、Y为正盐,X的水溶液显酸性,W为一元强碱(化学式为MOH),Z的电离方程式为_______。室温下,若用0.1 mol/L的W溶液滴定V mL 0.1 mol/L HA溶液,滴定曲线如图B所示,则a、b、c、d四点溶液中水的电离程度最大的是_______点;a点溶液中离子浓度的大小顺序为______________;取少量c点溶液于试管中,再滴加0.1 mol/L盐酸至中性,此时溶液中除H+、OH-外,离子浓度的大小顺序为______________。
(4)若X为强碱,常温下W为有刺激性气味的气态氧化物。常温时,将Z的水溶液露置于空气中,请在图C中画出其PH随时间(t)的变化趋势曲线图(不考虑水的挥发)。
正确答案
(1)Fe+4H++NO3-=Fe3++NO↑+2H2O
铁氰化钾或K3[Fe(CN)6]
(2)C(s)+1/2O2(g)=CO(g) △H= -110.5kJ/mol
(3)H++AlO2-+H2O

c
c(A-)>c(M+)>c(H+)>c(OH-)
c(M+)>c(A-)>c(Cl-)
(4)
解析
解析已在路上飞奔,马上就到!
知识点
13.水的电离平衡曲线如图所示,下列说法中,正确的( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法。关于26Al和10Be的说法不正确的是
正确答案
解析
略
知识点
高纯晶体硅是信息技术的关键材料。
(1)硅元素位于周期表的______周期______族,在周期表的以下区域中,可以找到类似硅的半导体材料的是________(填字母序号)。
a. 过渡元素区域
b. 金属和非金属元素的分界线附近
c. 含有氟、氯、硫、磷等元素的区域
(2)工业上用石英砂和焦炭可制得粗硅。
已知:
请将以下反应的热化学方程式补充完整:
SiO2(s) + 2C(s) === Si(s) + 2CO(g) △H = ________
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅。已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:_________,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷。
(4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅。
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响。根据下表数据,可用________ 方法提纯SiHCl3。
②用SiHCl3制备高纯硅的反应为
a. 该反应的平衡常数随温度升高而增大
b. 横坐标表示的投料比应该是
c. 实际生产中为提高SiHCl3的利用率,应适当升高温度
正确答案
见解析。
解析
(1)三 ⅣA b
(2)+638.4 kJ·mol-1
(3)C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”)
(4)①蒸馏(或分馏)
②a、c
知识点
我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为:
S+2KNO3 +3C→K2S +3CO2↑+N2↑。请根据其中所含的元素回答下列问题:
(1)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是_________;钾元素在周期表中的位置为_________。
(2)上述元素中,简单离子电子层结构与氩原子相同,且离子半径最大的元素,其原子核外有_________种不同能级的电子;已知其氧化物中一种对应水化物能与氯单质反应,该反应的化学方程式是 ___________________________。
(3)上述反应生成物中,属于非电解质的是________(写结构式);其中熔点最高的物质的电子式是_________。
(4)上述化学方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_________,能证明其递变规律的事实是( )(填字母)
A.最高价氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.其两两组合形成的化合物中元素的化合价
(5)上述反应中,如1.5mol还原剂_________(填“得到”或“失去”)_________mol电子,则生成_________g还原产物。
正确答案
(1)K元素的相对原子质量;第四周期IA族
(2)5,H2SO3+Cl2+H2O→H2SO4+2HCl
(3)O=C=O
(4)O>N>C,D
(5) 失去,6,69克
解析
略
知识点
主族元素M、R形成的简单离子M2-离子与R+离子的核外电子数之和为20,下列说法正确的是
正确答案
解析
略。
知识点
形成物质世界多样性的原因有
①元素种类;②同位素;③化学键成键方式;④同分异构现象;⑤同素异形现象
正确答案
解析
略
知识点
1.德国重离子研究中心于1996年在粒子加速器中首次成功合成了第112号元素的一个原子其质量数为277。2010年2月19日,为纪念著名天文学家哥白尼,国际纯粹与应用化学联合会将112号元素的元素符号定为“Cn” ,汉语名为“鎶”。关于该新元素的下列叙述不正确是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.日本在这次核泄漏事故中,核电站周围检测到的放射性物质包括碘131和铯137。其中碘131一旦被人体吸入,可能会引发甲状腺疾病。有关资料显示,铯137则会造成人体造血系统和神经系统损伤。下列有关说法正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
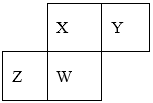
4.短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,.其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
正确答案
解析
A.同一周期的元素,原子序数越大,原子半径越小;不同周期的元素,原子核外电子层数越多,原子半径就越大。因此这四种元素的原子半径大小关系是:Z>W>X > Y,错误。
B.元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强。由于元素的非金属性:X>W>Z,所以它们的最高价氧化物对应水化物的酸性:X>W>Z,正确。
C.元素的非金属性越强,其相应的最简单的氢化物的稳定性就越强。由于元素的非金属性:Y>X>W>Z,所以元素的氢化物的稳定性:Y>X>W>Z,正确。
D.除非金属性很强的F、O元素外,一般情况下,元素原子的最外层电子数等于该元素原子的最外层电子数。X、Z、W的最高化合价分别与其主族序数相等,正确。
考查方向
解题思路
在短周期元素中,W原子的质子数是其最外层电子数的三倍,则W是15号的P元素,根据元素在周期表中的相对位置关系可确定:X是N元素,Y是O元素;Z是Si元素。
易错点
元素的推断。
知识点
12.有四种短周期元素(除稀有气体之外)X、Y、M、N,其中X是短周期中金属性最强的元素;Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍;M的单质是一种有色气体,可用于自来水的消毒;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多。下列说法正确的是
正确答案
解析
有四种短周期元素(除稀有气体之外)X、Y、M、N,其中X是短周期中金属性最强的元素,则X为Na;Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍,最外层电子数为6,原子有3个电子层,则Y为S元素;M的单质是一种有色气体,可用于自来水的消毒,则M为Cl;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多,则N为Al.A.X两种常见氧化物有氧化钠、过氧化钠,氧化钠只含有离子键,过氧化钠含有离子键、共价键,故A错误;B.N与M形成的化合物为氯化铝,铝离子水解,溶液呈酸性,故B正确;C.电子层结构相同,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:N(Al3+)<(Na+),Y(S2-)>(Cl-),故C错误;D.非金属性Y(S)<M(Cl),故气态氢化物的稳定性:Y<M,故D错误,故选:B.本题正确答案是B
考查方向
解题思路
有四种短周期元素(除稀有气体之外)X、Y、M、N,其中X是短周期中金属性最强的元素,则X为Na;Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍,最外层电子数为6,原子有3个电子层,则Y为S元素;M的单质是一种有色气体,可用于自来水的消毒,则M为Cl;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多,则N为Al.
易错点
物质结构、核外电子排布与元素的性质的关系。
知识点
3.W、X、Y、Z是原子序数依次增大的短周期主族元素。W的气态氢化物的水溶液显碱性,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍。下列说法正确的是()
正确答案
解析
A.分子晶体,沸点的比较看相对分子质量,相对分子质量大的,沸点就高H2O是18,NH3是17,CH4是16;四种元素的最简单气态氢化物中, H2O>NH3>CH4
B. Cl的简单阴离子不会发生水解
C.原子的半径:S>Cl>N>O
D.SO 2入BaCl2溶液中不会生成白色沉淀。
考查方向
解题思路
有X、Y、Z、W原子序数依次增大的短周期主族元素,其中W元素的气态氢化物水溶液显碱性,则W为N元素,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍,可推知X为O元素、Y为S、Z为Cl;据此解答。
易错点
分子晶体,沸点的比较看相对分子质量,相对分子质量大的,沸点就高。
知识点
10.五种短周期元素在周期表中的位置如图所示,其中R元素原子的最外层电子数等于其电子层数的2倍,下列判断正确的是
正确答案
解析
A选项,非金属性N元素大于C元素,所以该项错误;B选项,磷化氢稳定性弱于硫化氢,该选项错误;C选项,光导纤维的主要成分是二氧化硅,而Z是铝元素,所以该选项错误;D选项,硝酸的酸性大于碳酸,该选项是正确的。
考查方向
元素周期律和元素周期表
解题思路
根据题意分析可知元素X、Y、Z、M、R分别为C、N、Al、P、S,再结合元素周期律解决四个选项即可。
易错点
本题容易出现元素周期律的记忆错误。
知识点
10.根据元素周期律,由下列事实进行归纳推测,推测不合理的是
正确答案
B
解析
A、Mg、Ca与Ba均属于第ⅡA族,金属性依次增强,与水反应的剧烈程度也变大,正确;
B、半导体是指金属与非金属的交界线处,而不是第ⅣA族的元素,错误;
C、Cl、Br、I均为第ⅦA族元素,非金属性依次减弱,气态氢化物的稳定性依次减弱,正确;
D、Si、P、S为同一周期元素,非金属性依次增大,与氢气反应应依次更加容易,则条件逐渐变得容易,正确;所以答案为B。
考查方向
解题思路
高中化学里 这里的元素性质主要体现在三个方面:
1、金属性与非金属性
越靠左下侧的元素金属性越强,非金属性越弱;越靠右上侧的元素非金属性越强,金属性越弱。
2、原子半径
同周期元素,越靠右的原子半径越小;同族元素,越靠下的原子半径越大。
3、化合价
主族元素化合价=元素所在主族族序数=最外层电子数=价电子数。物理性质(例如熔沸点)是不可以从元素周期表上直接得出结论的。
易错点
1、元素的金属性和非金属性随与原子序数呈现周期性变化。
知识点
扫码查看完整答案与解析