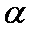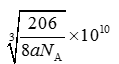- 物质结构与性质
- 共518题
9.短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
下列说法中正确的是
正确答案
解析
A光导纤维、棉花、油脂、ABS树脂来自高中化学课本体系的不同位置,但,都是所在部分的重点识记的知识内容。考察学生化学知识面的宽度,考察基础知识的巩固程度和重点知识的敏感度。光导纤维主要成分是SiO2。棉花是天然纤维,油脂是天然混甘油酯,棉花和油脂是天然有机高分子,ABS树脂是合成有机高分子。B、核能、太阳能、甲醇汽油、无磷洗涤剂分据不同章节,和社会生活热点息息相关。但低碳经济,低碳生活并不是书本知识。要了解低碳的含义,更要明确化学知识对低碳的实际意义。考察学生的应用化学知识解决生活问题或关注与化学有关的社会问题的应用积极性。其中无磷洗涤剂不能直接降低碳排放。C、红外光谱仪、核磁共振仪、质谱仪是研究有机物结构的基本实验仪器,课本集中在选修模块中。考察重点实验方法,体现重点知识与化学强调实验的特点。D、阴极射线、
知识点
某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验操作步骤:
Ⅰ. 打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ. A中看到白色沉淀时,…,关闭活塞a。
请回答:
(1)B中反应的离子方程式是________。
(2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
A.挥发性
B.还原性
C.氧化性
D.酸性
(3)C装置的作用是________,X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是________,D中反应的化学方程式是________。
(5)碳、硅的非金属性逐渐减弱的原因是________(从原子结构角度加以解释)。
正确答案
见解析。
解析
(1) CaCO3 + 2H+ = Ca2+ + CO2↑+ H2O
(2) A D
(3)除HCl气体 、 NaHCO3
(4)关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀后
Na2SiO3 + CO2 + H2O = H2SiO3(胶体)+ Na2CO3
(5)碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱。
知识点
二氯化二硫(S2C12)可用作橡胶工业的硫化剂,常温下它是橙黄色有恶臭的液体,它的分子结构与H202相似,熔点为l93 K,沸点为41lK,遇水很容易水解,产生的气体能使品红褪色,S2C12可由干燥的氯气通入熔融的硫中制得。下列有关说法正确的是
正确答案
解析
略
知识点
下列分子中所有原子都满足最外层为8电子结构的是 ( )
正确答案
解析
略
知识点
下列说法正确的是
正确答案
解析
略
知识点
锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
(1)碱性:Sr(OH)2 Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是 。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3 、FeO 、Fe2O3、Al2O3 、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:ⅰ.相同温度时的溶解度: BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
①Ⅰ中,反应的化学方程式是 。
②Ⅱ中,能与盐酸反应溶解的物质有 。
③Ⅳ的目的是 。
④下列关于该工艺流程的说法正确的是 。
a.该工艺产生的废液含较多的NH4+、Na+ 、Cl- 、SO42-
b.Ⅴ中反应时,升高温度一定可以提高SrCO3的生成速率
c.Ⅴ中反应时,加入溶液一定可以提高NH4HCO3的利用率
正确答案
见解析。
解析
(1)< 同一主族元素,原子最外层电子数相同
(2)①
②


③将



④a c
知识点
8. 韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。下列关于“暖冰”的说法正确的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。下列关于“暖冰”的说法中,正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。下列关于“暖冰”的说法中,正确的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.有关化学用语的表述正确的是
正确答案
解析
A.轨道表示式表示N2中的共用电子对,其中另一N原子的2p上的三个成单电子自旋方向要相反;
B.C.均错在“只能”上,还有很多其它双原子分子也符合;
D.的甲烷比例模型正确,是为正确选项。
考查方向
解题思路
准确理解轨道表示式、比例模型、球棍模型,及“只能”。
易错点
审题时忽视关键词“只能”等而错选B等。
知识点
1100℃时,在体积为5L的密闭容器中,发生可逆反应:Na2SO4(s)+4H2(g)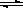
23.上述反应中涉及的非金属元素原子的半径从大到小的顺序为_____________,非金属性最强的元素原子的电子排布式_________________,其电子的自旋方向共有________种。
24.该反应中O、S属于同主族元素,比较它们的单质的氧化性 (用化学方程式表示),写出Na2O的电子式 ,比较Na2O和Na2S的熔点高低:Na2O Na2S。
25.上述平衡的平衡常数表达式K= 
26.能判断反应达到平衡状态的依据是 (填序号)A.混合气体的压强不变 B.混合气体的密度不变C.混合气体的
27.若初始时加入的Na2SO4为2.84g,10分钟后达到平衡时Na2SO4的转化率为45%,V(H2)= 。平衡后,向容器中充入1molH2,平衡向 (填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,H2的体积百分含量_____________(填“增大”、“减小”或“不变”)
正确答案
23..S>O>H ,1s22s22p4,2
解析
(23)方程式中出现的三种非金属元素分别为H、O、S,根据元素周期律电子层数越多半径越大,可知半径大小为S>O>H,非金属最强的为O元素,核外电子数为8,因此根据原子核外电子排布规则得知1s22s22p4,根据泡利原理可知自旋应该有2种.
考查方向
解题思路
准确把握结构决定性质,准确应用化学语言表达,应用元素周期律规律,化学平衡移动原理
易错点
位、枸、性三者关系,化学平衡原理
正确答案

解析
(24)根据同主族元素从上往下非金属性减弱即氧化性减弱的规律可知氧气的氧化性强于硫单质,因此2H2S+O2→2S+2H2O能充分说明和验证这一结论,电子式是一种表示物质结构的化学表述方式,常见的电子式书写需要注意离子化合物与共价键的书写,根据离子晶体熔沸点与离子半径有关的规律可知Na2O>Na2S。
考查方向
解题思路
准确把握结构决定性质,准确应用化学语言表达,应用元素周期律规律,化学平衡移动原理
易错点
位、枸、性三者关系,化学平衡原理
正确答案
25. [H2O]4/[H2]4,吸热
解析
(25)根据平衡常数的定义可知K=[H2O]4/[H2]4,根据K值只与温度有关,温度越高,K越大为吸热,K越小为放热可判断该反应为吸热反应。
考查方向
解题思路
准确把握结构决定性质,准确应用化学语言表达,应用元素周期律规律,化学平衡移动原理
易错点
位、枸、性三者关系,化学平衡原理
正确答案
26.BC
解析
(26)判断平衡的标志需要符合“变”到“不变”的物理特征以及建立平衡根本原因是正反应速率与逆反应速率相等,故选择BC。
考查方向
解题思路
准确把握结构决定性质,准确应用化学语言表达,应用元素周期律规律,化学平衡移动原理
易错点
位、枸、性三者关系,化学平衡原理
正确答案
27.7.2×10-4mol/(L·min),正反应方向,不变【考查方向】微粒半径大小的比较、原子核外电子排布、原子核外电子的运动状态、同一主族内元素性质递变规律、电子式、物质的结构与性质之间的关系、化学平衡常数的含义、化学平衡的影响因素、化学平衡状态的判断、化学平衡的计算
解析
(27)2.84g,10分钟后达到平衡时Na2SO4的转化率为45%能计算出硫酸钠消耗的物质的量从而得知氢气的物质的量,也就能得出氢气变化的浓度,据此计算V(H2)=7.2×10-4mol/(L·min),根据勒夏特列原理,增大反应物浓度将使得平衡向着正方向移动,由于该反应为气体前后气体体积相等的反应,依据等效平衡的特点,氢气的百分含量依然不变。
解题思路
准确把握结构决定性质,准确应用化学语言表达,应用元素周期律规律,化学平衡移动原理
易错点
位、枸、性三者关系,化学平衡原理
2.核反应不仅能发电也能制造元素.2016 年初国际上确认,利用原子核间的撞击已制造出原子序数分别为113、115、117 和118 四种新元素,填补了目前元素周期表的空白,其中113 号元素与Al 元素处于同一主族.下列说法正确的是()
正确答案
解析
A。核反应发电是核能到电能
B原子的电子层数与周期数相同,最外层电子数等于主族序数,115号元素原子有七个电子层,应位于第七周期,最外层有5个电子,则应位于第VA族,
C.第七周期稀有气体原子序数=86+32=118,是第七周期最后一种元素,位于18列,117号元素处于第七周期第17列,故117号元素位于第七周期第ⅦA族
D.四种新元素都在第四周期
考查方向
解题思路
周期表中,原子的结构决定着元素在周期表中的位置,原子的电子层数与周期数相同,最外层电子数等于主族序数.熟记稀有气体的质子数(或碱金属族元素的质子数),这些元素分别是每个周期最后(或开始)一种元素,He-2,Ne-10,Ar-18,Kr-36,Xe-54,Rn-86,第七周期稀有气体原子序数=86+32=118,再根据原子序数之间的差值确定.
易错点
原子核外电子排布与在周期表中的位置
知识点
13.下列离子方程式书写正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.【化学—选修3:物质结构与性质】
A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;B、C、D同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:(相关问题用元素符号表示)
(1)写出E的基态原子的电子排布式________________________________。
(2)B与C可形成化合物BC和BC2,BC2属于__________(填“极性”、“非极性”)分子,1 mol BC含有π键为______________mol。
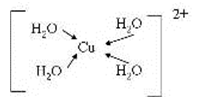
(3)由元素A、C、G组成的离子[G(A2C)4]2+在水溶液中显天蓝色,不考虑空间结构,[G(A2C)4]2+的结构可用示意图表示为__________(配位键用→标出)。
(4)测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的原因是_________,
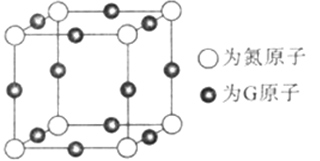
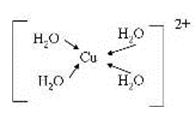
(5)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质,分子中含三个相同的原子团,其结构简式为____________________,分子中F原子的杂化方式为__________,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为____________________。 (6)G与氮元素形成的某种化合物的晶胞结构如图,则该化合物的化学式为__________,若晶体密度为a g·cm-3,列式计算G原子与氮原子最近的距离为____pm(不必计算出数值,阿伏加德罗常数的值用NA表示)。
正确答案
(1)1s22s22p63s2
(2)非极性 2
(3)
(4)HF分子之间存在氢键,形成缔合分子
(5)Al(CH3)3 sp2杂化
Al(CH3)3 +3H2O = Al(OH)3↓+3CH4↑
(6)Cu3N
解析
根据A的原子核外电子只有一种运动状态可知A为氢元素;B、C的价电子层中未成对电子数都是2且原子序数依次增大可知B、C分别为碳元素和氧元素;根据B、C、D同周期可知D为氟元素;E核外的s、p能级的电子总数相筹可知E的电子排布式为1s22s22p63s2 ,即为镁元素,由于原子序数依次增大且F与E同周期,第一电离能比E小可知F为半充满且第一电离反常铝元素;G的+1价离子(G+)的各层电子全充满可知G为铜元素;
(1)镁元素的基态原子的电子排布式为1s22s22p63s2 ;
(2)CO2分子中没有孤电子对,所以属于非极性分子,CO中含有碳氧三键,所以每个三键中含有2个π键,所以1 mol CO含有π键为2mol;
(3)[Cu(H2O)4]2+ 中含有配位键,Cu2+中有空轨道,H2O中O存在孤电子对,所以结构可用示意图表示为;
(4)由于HF分子之间存在氢键,形成缔合分子(HF)n,所以实验测定值一般高于理论值;
(5)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质的分子式为AlC3H9 ,由于分子中含三个相同的原子团,即为CH3,所以结构简式为 Al(CH3)3 ,CH3中碳原子的杂化方式为sp2杂化,该物质遇水爆炸,生成白色沉淀为Al(OH)3和无色气体CH4,反应方程式为 Al(CH3)3 +3H2O = Al(OH)3↓
+3CH4↑;
(6)Cu与氮元素形成的化合物的晶胞中,Cu原子为与晶胞的棱上,共有(1/4)×12=3,N 原子位于顶点上,共有(1/8)×8=1;所以则该化合物的化学式为Cu3N ;Cu原子与N原子最近的距离为棱长的
1/2,设距离为xcm,则根据密度计算公式ρ=m/V可知a =(206/NA)/(2x)3,所以x=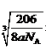
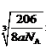
考查方向
解题思路
根据A的原子核外电子只有一种运动状态可知A为氢元素;
B、C的价电子层中未成对电子数都是2且原子序数依次增大可知B、C分别为碳元素和氧元素;
根据B、C、D同周期可知D为氟元素;
E核外的s、p能级的电子总数相筹可知E的电子排布式为1s22s22p63s2 ,即为镁元素,由于原子序数依次增大且F与E同周期,第一电离能比E小可知F为半充满且第一电离反常铝元素;G的+1价离子(G+)的各层电子全充满可知G为铜元素;
(1)镁元素的基态原子的电子排布式为1s22s22p63s2 ;
(2)CO2分子中没有孤电子对,所以属于非极性分子,CO中含有碳氧三键,所以每个CO中含有2个π键;
(3)[Cu(H2O)4]2+ 中含有配位键,Cu2+中有空轨道,H2O中O存在孤电子对;
(4)HF分子之间存在氢键,形成缔合分子(HF)n;
(5)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质的分子式为AlC3H9 ,由于分子中含三个相同的原子团,即为CH3,所以结构简式为 Al(CH3)3 ,CH3中碳原子的杂化方式为sp2杂化,该物质遇水爆炸,生成白色沉淀为Al(OH)3和无色气体CH4;
(6)Cu与氮元素形成的化合物的晶胞中,Cu原子为与晶胞的棱上,共有(1/4)×12=3,N 原子位于顶点上,共有(1/8)×8=1;Cu原子与N原子最近的距离为棱长的1/2;
易错点
由于不能有效掌握配位键的实质与题给信息的分析策略,所以不能准确判断出配位键;
空间想象能力薄弱,不能根据晶胞结构判断配位数,进而根据密度确定原子的距离。
知识点
扫码查看完整答案与解析