- 化学基本概念和基本理论
- 共1765题
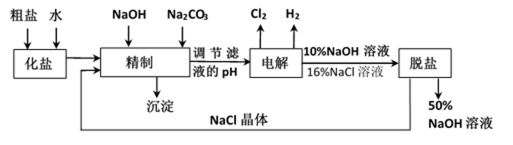
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为 。
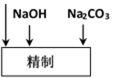
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去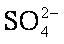
a. Ba(OH)2
b.Ba(NO3)2
c.BaCl2
(4)在实际生产中也可以用BaCO3除去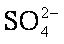
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、 (填操作名称)而制得50%的NaOH溶液。
正确答案
见解析。
解析
(1)H:H
(2)Mg2++2OH-=Mg(OH)2↓
(3)ac
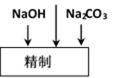
(4)由于BaSO4比BaCO3的溶解度小,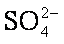

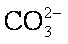
平衡正向移动,生成更难溶的BaSO4沉淀。
(5)结晶、过滤
知识点
水是最宝贵的资源之一。下列表述正确的是
正确答案
解析
略
知识点
27.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为 。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去SO42-,可选择下列溶液中的 (填字母序号)
a. Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、 (填操作名称)而制得50%的NaOH溶液。
(6)写出电解饱和食盐水的离子方程式:
正确答案
(1)H:H
(2)Mg2++2OH-=Mg(OH)2↓
(3)ac
(4)由于BaSO4比BaCO3的溶解度小,促使BaCO3(s)Ba2+(aq)+ (aq)
平衡正向移动,生成更难溶的BaSO4沉淀。
(5)结晶、过滤
(6)
解析
解析已在路上飞奔,马上就到!
知识点
26.A.B.C.D.E.F.G为原子序数依次递增的7种短周期主族元素。A.B元素的最高正价与最低负价的代数和均为零;C元素是植物生长三大营养元素之一;D的单质具有强氧化性,其氢化物能和一种半导体材料反应生成常温常压下的两种气体;E原子核外K层电子数与M层电子数相等;F原子的价电子数等于电子层数的两倍。请回答下列问题:
(1)CD3 的电子式为( );
(2)用离子方程式表示G 的非金属性比F强( );
(3)EF在空气中充分灼烧生成一种稳定性的盐,则此反应方程式为 ( );
(4)C的氢化物与G的单质以物质的量之比1:3反应,生成二元化合物X和一种气体,该气体遇氨气产生“白烟”,则X的化学是为( ),X与水反应的产物名称是( );
(5)已知充分燃烧一定量的B2A2放出Q kJ的能量,燃烧生成的产物恰好与100ml 5 
(6)常温下,E(OH)2在水中的沉淀溶解平衡曲线如图所示(单位

正确答案

解析
解析已在路上飞奔,马上就到!
知识点
27. 现有A、B、C、D、E五种原子序数依次增大的短周期元素,其中在所有的短周期元素中,A的原子半径与D的原子半径之比最小(不包括稀有气体),C与A、B、D均能形成多种常见化合物,B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐,化合物AE常温下为气体。回答下列问题:
I.(1)A分别与B、C形成的最简单化合物中,稳定性( ) > ( )(用分子式表示),其中A与C形成的最简单化合物分子的空气构型为( )。
(2)化合物甲、乙均是由上述五种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1:1:1,其中乙是某种家用消毒液的有效成分,则化合物甲的电子式为( )。
(3)化合物丙由A和B两种元素组成,则化合物丙易液化的原因是( )。
(4)写出由这些元素组成一个不同主族单质间的置换反应方程式 ( )。
II.(1)金刚石属于( )晶体,如果其晶体中有1mol碳原子,则C—C键的数目为
NA。
(2)在氯化艳晶体中,与一个氯离子距离最近且相等的铯离子数是( )个。
(3)X射线测得氯化钠晶体中靠得最近的Na+与Cl—离子间的距离为dcm,经测定NaCl晶体的密度为

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)写出N2H62+在碱性溶液中反应的离子方程式 ( ) 。
(2)NH2-的电子式为( )。
(3)N3-有( ) 个电子。
(4)写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式( ) 、( ) 。
(5)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是( ) 。
正确答案
(5)一个单位正电荷
解析
解析已在路上飞奔,马上就到!
知识点
28. A、B、C、D、E是由短周期元素组成的六种常见物质。已知:
①常温下均呈气态,其中B、C、F为单质;
②实验室制取B时,用排饱和食盐水法收集可减少B的水中的溶解;
③A与B反应生成C和D,A的水溶液呈碱性,D的水溶液呈酸性;
④C与F在放电条件下反应生成E,E遇空气变色。
回答下列问题:
(1)A的电子式是( ),实验室制取B的化学方程式为( ) 。
(2)A的水溶液呈碱性的原因是( )(结合化学用语说明),将等物质的量浓度、等体积的A、D溶液混合,所得溶液中离子浓度由大到小依次排列为( ) 。
(3)一定条件下A与F反应可生成C和一种无色无味液体,该反应中氧化剂与还原剂的物质的量之比为( )。
(4)组成C、B两物质的元素,按原子个数1:3形成化合物G,G是一种淡黄色液体,遇水即发生水解可生成一种具有漂白性的物质,写出反应的方程式 ( );该反应说明组成C、B两物质的元素中非金属性较强的是 ( )。(填元素符号)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.水、双氧水都是由氢、氧元素组成的重要化合物。下列表述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.氯化硫(

(1)仪器名称:d________________,e________________
(2)已知S2Cl2分子中各原子最外层均满足8电子稳定结构,则S2Cl2的电子式________________。
(3)装置a中应放试剂为________,装置C为何水平放置?________________。
(4)f装置中应放置的试剂为________________,其作用为________________。
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式________________________。
正确答案
(1)直形冷凝管(或冷凝管);蒸馏烧瓶
(2)
(3)浓H2SO4 ;防止熔融的硫堵塞导管
(4)碱石灰;吸收Cl2尾气,并防止空气中的水汽使S2Cl2水解
(5)
解析
解析已在路上飞奔,马上就到!
知识点
26.学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3—、Cl—、MnO4—、SO42—等离子中的几种离子。
①经实验可知溶液明显呈酸性。
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲,向滤液中加入AgNO3溶液未见沉淀产生。
③另取少量该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当沉淀增加到一定量后开始产生气体丙,最后沉淀完全溶解。
(1)写出气体丙的电子式___________________。
(2)该溶液中一定不含有:___________________(填离子的化学式)离子,一定含有的离子有___________(填离子的化学式)。
(3)在这些不存在的离子中,有一种离子在酸性环境中与SO2反应,试写出该反应的离子方程式:________________________。
(4)请设计实验方案,检验该试液中是否存在可能含有的离子____________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
highway
正确答案
10.除去下列物质中的杂质选用的试剂和方法最合理的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.某反应池中,发生“生物硝化过程”,利用O2将NH4+氧化成NO3-,如果不考虑过程中硝化细菌的增殖,其净反应如下式所示:
(1)完成上述反应的离子方程式并配平,将系数填入方框中,并标出电子的转移方向和数目。
(2)反应中,还原剂是_____________,被还原的元素是_____________。
(3)将铵态氮中的lmg氮转化成硝酸根中的氮,需氧气_____________mg。(精确到0.01)
(4)取100mL完全反应以后的溶液,加入19.2g铜粉及一定量的稀硫酸,恰好完全反应(假设还原产物全部是NO气体),则原溶液中NH4+的浓度为_____________mol/L。(假设反应前后溶液的体积不变)
正确答案
(1)
(2)NH4+ 、 O2中的O
(3)4.57
(4) 2
解析
解析已在路上飞奔,马上就到!
知识点
26.黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的
请回答下列问题:
(1)称量样品所用的仪器为____________,将样品研细后再反应,其目的是___________________________。
(2)装置a的作用是________。
A.有利于空气中氧气充分反应
B.除去空气中的水蒸气
C.有利于气体混合
D.有利于观察空气流速
(3)上述反应结束后,仍需通一段时间的空气,其目的是__________________________。
(4)滴定时,标准碘溶液所耗体积为_______mL。
判断滴定已达终点的现象是__________________________。
(5)通过计算可知,该黄铜矿的纯度为_______________。
(6)若用如图装置替代上述实验装置d,同样可以达到实验目的的是____。(填编号)
正确答案
(1)电子天平 ; 提高反应速率,并使黄铜矿充分反应
(2)BD
(3)把装置中的二氧化硫气体全部吸收
(4)20.00 ;溶液由无色变成蓝色,并半分钟内不褪色
(5)80%
(6)②
解析
解析已在路上飞奔,马上就到!
知识点
12.据美国《科学》杂志报道,外太空的某个星球的大气层中含有大量的CH2=CHOH,此物质常温下为液体,不稳定,易转化为CH3CHO,方程式为CH2=CHOH→CH3CHO +Q(Q﹥0)。据此,以下叙述中不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析