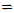- 化学基本概念和基本理论
- 共1765题
20.某二元酸(化学式H2A)在水中的电离方程式是H2A→ H+ + HA-、HA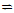
正确答案
解析
每小题有一个或两个正确选项,只有一个正确选项的,多选不给分,有两个正确选项的,选对一个给2分,选错一个该小题不给分。
知识点
20.双球连通管中发生2 NO2 
正确答案
解析
每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个,该小题不给分
知识点
11.乙苯是一种重要的化工原料.以乙苯为原料通过以下转化可得多种化工产品.
己知:
I.
Ⅱ.
Ⅲ.A中苯环上的一氯代物只有2种
(1)写出物质A的分子式________,M的结构简式:_______.
(2)C中苯环侧链所含官能团的名称是_________________.
(3)E→F的反应类型是______________.[来源:Z。xx。k.Com]
(4)关于.B的说法正确的是_______.(填选项字母)
a.能发生银镜反应b.能发生消去反应c.遇FeCl3溶液发生显色反应d.能与H2发生加成反应
(5)写出D→E反应的化学方程式:________.
(6)符合下列条件的A的同分异构体有________种(不考虑立体异构),写出任意一种同分异构体的结构简式:_______.
①苯环上有3个取代基
②遇FeCl3溶液发生显色反应
③能与溴水发生加成反应
正确答案
(1)C9H10O;CH3CHO
(2)碳碳双键、醛基
(3) 加聚反应
(4)abd
(5)
(6)10;
解析
解析已在路上飞奔,马上就到!
知识点
18.氮元素可以形成多种氢化物,如NH3、N2H4等。
(1)据报道,2016年中国将发射“天宫二号”空间实验室,并发射“神舟十一号”载人飞船和“天舟一号”货运飞船,与“天宫二号”交会对接.火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4作氧化剂.
已知:N2g)+O2(g)⇌2NO(g)△H=+180.7kJ.mol﹣1
2NO(g)+O2(g)⇌2NO2(g)△H=﹣113.0kJ.mol﹣1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣534.0kJ.mol﹣1
2NO2(g)⇌N2O4(g)△H=﹣52.7kJ.mol﹣1
写出气态肼在气态四氧化二氮中燃烧生成氨气和气态水的热化学方程式:____________.
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如下所示:
①该反应的△H___0(填“>”或“<”).
②已知原料气中的氨碳比[
(3)①在氨水加水稀释的过程中,NH3.H2O的电离程度_____(填“增大”、“减小”或“不变”,下同),
②室温下,amol•L﹣1的(NH4)2SO4溶液的pH=5,原因是_______(用离子方程式表示),该反应的平衡常数为________(用含a的数学表达式表示).
正确答案
(1)2N2H4(g)+N2O4(g)⇌3N2(g)+4H2O(g)△ H=﹣1083.0kJ•mol﹣1
(2)<;增大c(NH3),平衡正向移动,从而提高CO2的转化率;42%
(3)不变;NH4++H2O⇌NH3•H2O+H+;
解析
解析已在路上飞奔,马上就到!
知识点
21.盐酸.硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1)常温下,可用铁.铝制的容器盛放浓硫酸,说明浓硫酸具有__________性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有__________ 性。
用玻璃棒蘸取浓硝酸滴在PH试纸上,试纸逐渐变白,这种漂白现象说明浓硝酸具有_______性。
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是__________(填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2
② Cu + HNO3(稀)→ Cu(NO3)2
③
(3)在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,若使剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 __________。
(4)若将12.8g铜跟一定质量的浓HNO3反应,铜消耗完时,共产生气体5.6L(标准状况) (不考虑N2O4),则所耗HNO3的物质的量__________mol.
(5)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 __________。
正确答案
(1)(强)氧化性 脱水性、 (强)氧化性
(2)③
(3)3Cu + 8H+ + 2NO3- = 3Cu2+ + 2 NO ↑+ 4H2O
(4)0.65
(5) Cu+2HCl+H2O2=CuCl2+2H2O
解析
解析已在路上飞奔,马上就到!
知识点
3.下列说法中,正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.部分中学化学常见元素原子结构及性质如下表所示:
(1)A元素在周期表中的位置为_______________________________________。
(2)B与C形成的化合物的化学式为________,写出此化合物与水反应的化学方程式( )
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,请写出用电子式表示Y形成过程的式子______________________________________。
②F与C组成的两种化合物M和N所含的电子
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱:
_________________________________________________________________。
(5)有人认为B、D的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写): ________________。
正确答案
(1)第四周期第Ⅷ族
(2)Mg3N2 Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
(3)
①
② 碱
(4)4NH3+3O2 
(5)Al-3e-+4OH-=AlO2-+2H2O
解析
解析已在路上飞奔,马上就到!
知识点
8.某化学课外活动小组通过实验研究NO2的性质。已知:2NO2+2NaOH=NaNO3+NaNO2+H2O
任务1:利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
(1)E装置中制取NO2反应的化学方程式是____________________
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是__________________
(3)实验过程中,未能观察到C装置中的预期现象.该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③_____________________________.
(4)此实验装置存在一个明显的缺陷是__________________.
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:____________________.
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图2所示),重新组装,进行实验.
①装置的合理连接顺序是(某些装置可以重复使用)__________________.
②实验过程中,B装置中淡黄色粉末逐渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为_____________________.
正确答案
(1)Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
(2)C装置中混合气体颜色变浅
(3)
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③在此条件下,该反应的化学反应速率极慢
(4)缺少尾气吸收装置
(5)NO2能被Na2O2还原
(6)EDBDF或EDBF;2NO2+Na2O2═2NaNO3
解析
解析已在路上飞奔,马上就到!
知识点
24.已知氧化性:Br2>Fe3+>I2,向含有a mol FeI2的溶液中加入含b mol Br2的溴水,下列判断或相应的离子方程式正确的是(忽略离子的水解)( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
下列有关化学用语表示正确的是
正确答案
解析
有关化学用语常涉及常见物质的组成和结构,尤其是一些常见物质电子式、结构式、结构简式及模型等等,内容比较基础。
知识点
17.将Fe和Fe2O3的混合物加入25mL 2mol/L的HNO3溶液中,反应完全后,无固体剩余,生成224mL NO气体(标准状况),再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积至少是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
下列有关化学用语表示正确的是
正确答案
解析
有关化学用语常涉及常见物质的组成和结构,尤其是一些常见物质电子式、结构式、结构简式及模型等等,内容比较基础。
知识点
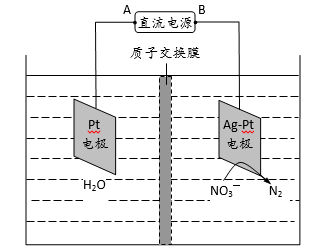
化学在环境保护中趁着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1) 催化反硝化法中,H2能将NO3—还原为N2,25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应离子方程式为 ,其平均反应速率v(NO3—)为 mol ∙L—1 ∙min—1
③还原过程中可生成中间产物NO2—,写出3种促进NO2—水解的方法 。
(2)电化学降解NO3—的原理如题图所示。
①电源正极为 (填“A”或“B”),阴极反应式为 。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
正确答案
(1)①N≡N
②
③加酸,升高温度,加水
(2)①A, 2NO3-+6H2O+10e-=N2+12OH-
②14.4
解析
(1)①N2分子中氮原子间通过氮氮三键结合,因此其结构式为N≡N;②利用溶液pH变化可知有OH-生成,再结合原子守恒可写出反应的离子方程式;利用离子方程式知v(NO3-)=v(OH-)=(10-2-10-7)/10=0.001mol/(L·min);③水解是吸热反应,NO2-水解使溶液中c(OH-)变大,因此可促进NO2-水解的措施有加热、加水或加酸等。
(2)①由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有OH-生成;②转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g。
知识点
下列有关化学用语表示正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析