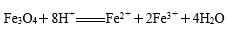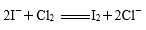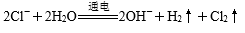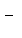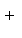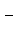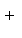- 化学基本概念和基本理论
- 共1765题
下列离子方程式书写不正确的是
正确答案
解析
略
知识点
下列离子方程式书写正确的是( )
正确答案
解析
略
知识点
下列根据实验操作及其现象描述所写离子方程式正确的是
正确答案
解析
略
知识点
藏硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,僵使用过量会使人中毒,国酥上对食品中亚硝酸钠的用量控制在很低的本平上。某学习小组针对亚硝酸钠设计了如下实验:
该小组查阅资料知: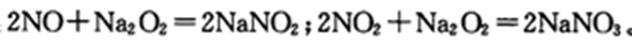
(1)装置D可将剩余的NO氧化成N03,发生反应的离子方程式为____。
(2)如果没有B装置,C中发生的副反应有____。
(3)甲同学梭在完气密往良好后进行实验,发现NaNO2的纯度较低。乙简学对上述装置进行了改进后提高了NaNO2的纯度,其改进措施是____。
(4)丙同学撩B中的药品进行了更换,也提高了NaNO2鲍纯度。丙更换的药最是 。
【实验Ⅱ】测定甲、乙同学制取样晶中NaNO2的含量
步骤:a,在5个有编号的带刻度试管(比色管)中分别加入不同量的
b,分别称量0。10 g甲、乙制得的样品溶于水配成500 mL溶液,贴上标签甲、乙。再分离别取5 mL甲、乙待测液,各加入1 mL M溶液,均加蒸馏水至10 mL振荡,分别与标准色阶比较。
(5)步骤b中比较结果是:甲待测液颜色与③号色阶相同,乙待测液颜色与④号色阶相同。则甲同学制得的样品中NaN02的纯度是____%。
(6)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。
正确答案
(1)5NO +3MnO4-+4H+ = 5NO3-+3Mn2++2H2O(2分)
(2)2Na2O2+ 2H2O = 4NaOH+O2↑(1分) 2NO + O2= NO2(1分)
(3)在A、B之间增加装有水的洗气瓶(2分)
(4)碱石灰或氧化钙(2分)
(5)40(2分)
(6)实验方案:取5mL甲待测液加入维生素C,振荡,再加入1 mL M溶液,加入蒸馏水至10mL(1分,“取5mL甲待测液”、“加入维生素C”、“加入1 mL M溶液”、“加入蒸馏水至10mL”四个要点,答出三个以上得1分);再振荡,与③号色阶对比(1分)。
实验现象:紫红色比③色阶浅(1分)。
解析
略
知识点
下列反应的离子方程式书写正确的是
正确答案
解析
略
知识点
下列反应的离子方程式正确的是
正确答案
解析
略
知识点
下列离子方程式正确的是
正确答案
解析
略。
知识点
水是生命之源,也是人类最宝贵的资源。饮用水的制取通常包括:混凝沉淀、杀菌消毒、硬水软化等过程。
(1)生活中人们常用明矾来作净水剂,除去水中的悬浮物。请用离子方程式表示明矾净水的原理____。
(2)ClO2是国际上通用的饮用水消毒剂。科学家用硫酸酸化的草酸(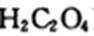
(3)高铁酸钾(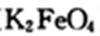
(4)硬水的软化通常有药剂法、离子交换法等。
①某学习小组用生石灰和纯碱软化硬水的工艺流程图如下:
试剂a箍____;沉淀M是 (写化学式);加入试剂b后生成沉淀的离子方程式为____。
②离子交换法是用阳离子交换树脂(HR)和水中的金属离子Mn+进行交换的一种方法。写出用HR软化硬水的相关离子方程式 。
(5)某同学欲对用ClO2消毒过的水进行CI-含量的测定,实验过程如下:向30.00 mL水样中加几滴K2ClO4溶液作指示剂,用0.001000 mol.L-l AgN溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达到滴定终点,此时用去籼辩毡溶液12.12 nlL。则水样中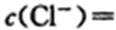
正确答案
(1)Al3+ + 3 H2O 
(2)H2C2O4+2NaClO3+H2SO4 = Na2SO4+2CO2↑+2ClO2↑+2H2O(2分)
(3)高铁酸钾中铁为高价,有强氧化性,具有杀菌作用;高铁酸钾被水中还原性物质还原,生成的Fe3+水解产生Fe(OH)3 ,具有吸附作用。(2分)
(4)①CaO (1分) Mg(OH)2 (2分) Ca2++CO32+ = CaCO3↓(2分)
②2HR + Ca2+ = CaR2 + 2H+(1分) 2HR +Mg2+ = MgR2 + 2H+(1分)
(5)4.04×10 -4 mol·L-1 (2分)
解析
略
知识点
下列离子方程式与所述事实相符的是
正确答案
解析
略
知识点
中学常见反应的化学方程式是A+B→X+Y+H2O(未配平,反应条件略去)。请回答:
(1)若A为红色金属单质,B是浓硫酸,写出该反应的化学方程式 ,检验其中的气体产物X的方法是
(2)若A为黑色固体,Y是黄绿色气体,写出 Y的电子式 ,该反应的离子方程式是 。将气体Y通入氢氧化钠溶液中加热发生反应,当消耗6.72 L(标准状况)的气体Y时,转移0.5 mol 电子,写出该反应的化学方程式
(3)若A为金属单质,B是稀硝酸溶液,当A与B以物质的量之比为1:4进行反应,生成无色气体X,X遇空气立即变为红棕色。且A可溶于Y溶液中。
①写出该反应的化学方程式
②含a mol Y的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的Y是 mol。
正确答案
见解析。
解析
(1)
(2)

3Cl2+6NaOH=5NaCl+NaClO3+3H2O
(3)①Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
②0.4a
知识点
Na2SO3是抗氧剂。向烧碱和Na2SO3的混合溶液中加入少许溴水,振荡溶液变为
无色。
(1)SO2是大气污染物,是形成 的因素之一,实验室用亚硫酸钠固体与一定浓度的硫酸溶液反应制备SO2气体,写出该反应的化学反应方程式 。
尾气通入过量NaOH溶液可得到烧碱和Na2SO3的混合溶液,该反应的离子反应方程式为 。
(2)碱性条件下Br2与Na2SO3溶液反应的离子方程式为 。
(3)硅酸钠溶液俗称水玻璃。取少量硅酸钠溶液于试管中,通入过量的SO2,得到沉淀物。写出该反应的离子方程式: 。
(4)CO2气体中含有少量SO2气体,要除去SO2杂质,将混合气体通入 试剂,其
反应的离子方程式: 。
(5)为了探究氨还原性,某研究小组用氨和CuO在加热条件下反应,产物中得到一种红色
固体和一种气体单质。写出反应化学方程式 。
正确答案
(1)酸雨(2分) SO32- + 2H+ = SO2↑+ H2O (2分)
SO2 + 2NaOH = Na2SO3 + H2O (2分)
(2)Br2 + SO32- + 2OH- = 2Br- + SO42- + H2O (2分)
(3)SiO32- + 2SO2 + 2H2O = H2SiO3↓ + 2HSO3- (2分)
(4)3CuO + 2NH3
(5)饱和碳酸氢钠溶液 (2分) HCO3- + SO2 = HSO32- + CO2(2分)
解析
略
知识点
下列表示对
正确答案
解析
略。
知识点
下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是
①碳酸钠溶液与盐酸 ②偏铝酸钠溶液与盐酸 ③二氧化碳与氢氧化钠溶液
④硝酸银溶液和氨水 ⑤氯化铝与氨水 ⑥碳酸氢钠溶液与澄清石灰水
正确答案
解析
略
知识点
在硫酸酸化的碘化钾溶液里加入过量的过氧化氢溶液,不久就有无色小气泡从溶液中逸出,且溶液呈棕色,下列叙述中错误的是( )
正确答案
解析
略
知识点
向碳酸氢镁溶液中逐滴加入澄清石灰水,下列离子反应可能发生的是:
正确答案
解析
略
知识点
扫码查看完整答案与解析