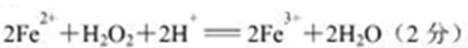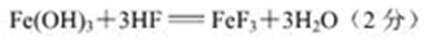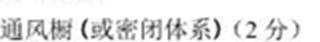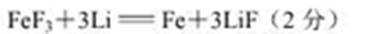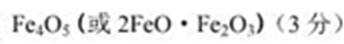- 复杂化学式的确定
- 共54题
白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷。卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如右图所示。该结构中氯原子有两种不同位置。
(1)6.20g白磷在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为___________________L。
上述燃烧产物溶于水配成50.0mL磷酸(H3PO4)溶液,该磷酸溶液的物质的量浓度为______________________mo1/L。
(2)含0.300mol H3PO4的水溶液滴加到含0.500mol Ca(OH)2的悬浮液中,反应恰好完全,
生成l种难溶盐和16.2g H2O。该难溶盐的化学式可表示为________________________________。
(3)白磷和氯、溴反应,生成混合卤化磷PCl5-XBrX(1≤x≤4,且x为整数)。
如果某混合卤化磷共有3种不同结构(分子中溴原子位置不完全相同的结构),该混合卤化磷的相对分子质量为________________________________________。
(4)磷腈化合物含有3种元素,且分子中原子总数小于20。0.10mol PCl5和0.10mol NH4Cl恰好完全反应,生成氯化氢和0.030mol磷腈化合物。推算磷腈化合物的相对分子质量(提示:M>300)。
正确答案
(1)5.6 4.00
(2)Ca5(PO4)3(OH)
(3)297.5 或342
(4)348和464
解析
略
知识点
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠___g。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。
(i)计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
(ii)计算并确定该钠-钾合金的化学式。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O
己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
正确答案
见解析。
解析
(1) 78 ;
(2)
(i)c(OH-)=
(ii)设上述合金中含amolNa、bmolK, a+b=0.75×2 23a+39b=5.05
a=0.050mol b=0.10mol,该钠-钾合金化学式为NaK2
(3)溶液含NaOH,NaOH与CO2反应生成的Na2CO3:15-
112LCO2的物质的量:112/22.4=5(mol) n[Al(OH)3]:n(Na2CO3)=[(5-3)×2]:5=4:5。
(4)由NaCl质量推算,氢氧化钠样品摩尔质量为:
M1(NaOH)=
M2(NaOH)=
M2(NaOH)=
结论:实验①所取氢氧化钠样品是NaOH;实验②和③所取氢氧化钠样品应该是NaOH·H2O。
本题以元素化合物为载体命题,意在考查考生的计算能力和分析、推理能力。
(1)利用“N”守恒可知需m(NaN3)=(40.32L/22.4L·mol-1)×2/3×65g·mol-1=78g。
(2)①由反应方程式可知产生1molH2同时生成2molOH-,故c(OH-)=(0.075mol×2)/0.2L=0.75mol/L;②设合金中Na、K的物质的量分别为amol、bmol,然后利用质量守恒与得失电子守恒可得方程式:a+b=0.75×2 和23a+39b=5.05,解之得a=0.050mol、b=0.10mol,故可得到合金的化学式为NaK2。
(3)若溶液中仅含NaAl(OH)4,利用方程式可知得到24molAl(OH)3的同时生成12molNa2CO3,而实际得到24molAl(OH)3与15molNa2CO3,说明溶液中含有NaOH,且NaOH优先与CO2反应生成Na2CO3,利用Na守恒知溶液中n(NaOH)=(15-12)mol×2=6mol,故通入112LCO2(5mol)先与NaOH作用消耗CO23mol生成3mol Na2CO3,然后2molCO2与NaAl(OH)4作用得到4molAl(OH)3和2mol Na2CO3,故生成n[Al(OH)3]:n(Na2CO3)=4:(3+2)=4:5。
(4)由NaOH+HCl=NaCl+H2O可知溶液PH=7时,二者恰好反应,故三次实验得到的固体均为纯净的氯化钠,故利用“钠守恒”得m(NaCl)/M(NaCl)=m(氢氧化钠样品)/M(氢氧化钠样品),利用该式和题中数据可计算出三次实验中所取氢氧化钠样品的摩尔质量,进而可得出结论。
知识点
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式。
该氢化物受撞击则完全分解为氮气和氢气。4.30g该氢化物受撞击后产生的气体在标准状况下的体积为_______L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0kg水,计算推进剂中联氨的质量。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为
6NO+ 4NH3=5N2+6H2O
6NO2+ 8NH3=7N2+12H2O
NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156mol氮气,吸收后氨水密度为0.980 g/cm3。
计算:①该混合气体中NO与NO2的体积比。②吸收后氨水的物质的量浓度(答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80mol NH3,生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比。
正确答案
(1)HN3 ;4.48
(2)64kg
(3)9:1;2.4molL
(4)3:1:1
解析
本题主要考察与化学有关的计算。
(1)一分子该氢化物中分子中含氮原子个数
(2)根据题意书写出方程式为2HN3=3H2+N2,则1mol该氢化物受撞击后产生的气体为2mol,4.30g氢化物的物质的量为0.1mol,产生0.2mol气体,标况下为4.48L。
(3)由联氨和四氧化二氮完全反应写出方程式为2N2H4 +N2O4=3N2+4H2O,生成72.0kg水需要联氨64kg。
①设NO与NO2的物质的量分别为x、y,则根据方程式:

联立方程组解得x=162mol y=18mol
根据阿伏伽德罗定律,二者体积比为162mol:18mol=9:1
②氨水中溶质的总物质的量为
根据反应方程式,消耗的氨气物质的量为
则吸收后的溶液中氨水的物质的量为157.058-132=25.058mol
吸收后的溶液中氨水的体积为
氨水物质的量浓度为25.058mol/10.43L=2.4molL
(4)由提示可得,生成链状二聚物、三聚物的方程式可简写为
2CO(NH2)2→二聚物+NH3 ……………………………①
3CO(NH2)2→三聚物+2NH3 ……………………………②
可以推出参加反应的尿素和生成氨气的物质的量之差为生成聚合物的物质的量
因此生成聚合物的物质的量=120mol-80mol=40mol
根据聚合物中碳原子守恒,可计算聚合物中平均含碳原子个数为120mol/40mol=3,而链状二聚物和三聚物的混合物中平均碳原子数只能小于3,说明除了生成链状二聚物、三聚物外还有环状三聚物,则 CO(NH2)2→环状三聚物+3NH3…………………………③
设生成二聚物、链状三聚物、环状三聚物的物质的量分别为x、y、z,则依据上述三个方程式,列方程组:

x + 2y +3z =80 mol
解得x=30mol y=10mol z=10mol
故三种聚合物的物质的量之比为30:10:10=3:1:1
另解:设最后产物中链状三聚物的物质的量分数为x,环状三聚物的物质的量分数为y,根据参加反应的尿素和生成的氨气比例列方程:

故三种聚合物的物质的量之比为0.6:0.2:0.2=3:1:1
知识点
碳酸氢纳俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂,制酸剂,灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。
(1)某碳酸氢钠样品中含有少量氯化钠。称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL。若改用0.05618mol/L硫酸滴定,需用硫酸 mL(保留两位小数)。
(2)某溶液组成如表一:
问该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二:
计算析出的碳酸氢纳晶体的质量(保留1位小数)。
(3)将组成如表二的溶液加热,使碳酸氢纳部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸纳,使溶液组成回到表一状态。计算补加的碳酸纳质量(保留1位小数)。
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg。通过计算确定该晶体的化学式。
正确答案
(1)17.80mL
(2)1044.6
(3)659.1
(4)
解析
(1)根据反应可知消耗的



(2)
解得m=1073.1
则析出的碳酸氢钠的晶体的质量:1073.1-(428.8-400.3)=1044.6kg
(3)
解得x=17.98
则补加的碳酸纳质量814.8-137.7-17.98=659.7kg
(4)
解得y=212


168kg,水72kg。三者物质的量之比为1:1:2,该晶体的化学式为
知识点
PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1 mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3:2,则剩余固体的组成及物质的量比是
正确答案
解析
本题通过元素化合物转化考查考生计算、分析推理能力。PbO2受热分解得到氧气和铅的氧化物的混合物(Pb为+4、+2价),铅的氧化物的混合物再与盐酸作用时,+4价Pb还原为+2价,Cl-被氧化为Cl2,此时得到溶液为PbCl2溶液,利用“电荷守恒”知1molPbO2在上述转化过程中共转移2mole-。设该过程得到O2的物质的量为3xmol,则Cl2的物质的量为2xmol,利用电荷守恒可得:3x×4+2x×2=2,解得x=0.125,故知1mol PbO2在受热分解过程中产生0.375molO2,利用原子守恒可知受热后的剩余固体中n(Pb):n(O)=4:5,结合选项可知只有A、D项满足n(Pb):n(O)=4:5,故答案为:AD。
知识点
某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静
置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80'c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以1000C预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是___(用离子方程式表示)
(2)步骤②的反应瓶材质可能是___(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反
应的化学方程式为____
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成
Fe3十,然后把溶液蒸干,灼烧至恒重得9.6 g固体,则该铁氧体的化学式为____。
正确答案
(1)
(2)C(2分)
(3)
(4)
(5)
(6)
解析
略
知识点
以水氯镁石(主要成分为
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的

(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为 。
(3)高温煅烧碱式碳酸镁得到

(4)若热水解不完全,所得碱式碳酸镁中将混有
正确答案
(1)2.0 mol/L -1
(2)NH4Cl
(3)n(CO2)=0.896L/22.4L·mol-1=4.00×10-2 mol
n(MgO)=2.00g/40g·mol-1=5.00×10-2 mol
n(H2O)=(4.66g-4.00×10-2 mol×44g·mol-1-2.00g)/18g·mol-1=5.00×10-2 mol
n(MgO):n(CO2): n(H2O)=5.00×10-2: 4.00×10-2: 5.00×10-2=5:4:5
碱式碳酸镁的化学式为:Mg(OH)2·4 MgCO3·4H2O
(4)升高
解析
略
知识点
硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2. 3350 g 样品,配制成100. 00 mL 溶液A;②准确量取25. 00 mL 溶液A,用0. 04000 mol·L-1 的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+ ),消耗EDTA 标准溶液31. 25 mL;③另取25. 00 mL溶液A,加足量的NaOH 溶液并充分加热,生成NH3 56. 00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA 标准溶液润洗,测得的Ni2+含量将 (填“偏高”、或“偏低”或“不变”)。
(2)氨气常用 检验,现象是 。
(3)通过计算确定银硫酸镍铵的化学式(写出计算过程)。
正确答案
见解析。
解析
(1)偏高
(2)湿润的红色石蕊试纸 试纸颜色由红变蓝
(3)n(Ni2+)= 0. 04000 mol·L-1×31. 25 mL×10-3L·mL-1 =1. 250×10-3 mol
n(NH4 +)= =2. 500×10-3 mol
n(SO42-)= ==2. 500×10-3mol
m(Ni2+)= 59 g·mol-1×1. 250×10-3 mol=0. 07375 g
m(NH4+)= 18 g·mol-1×2. 500×10-3 mol=0. 04500 g
m(SO42-)= 96 g·mol-1×2. 500×10-3 mol=0. 2400 g
n(H2O)= 1. 250×10-2 mol
x :y :m:n= n(NH4+):n(Ni2+):n(SO42-):n(H2O)= 2:1:2:10
硫酸镍铵的化学式为(NH4)2Ni(SO4)2·10H2O
知识点
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
请回答下列问题:
(1)元素Z位于周期表中第__________周期,__________族;
(2)这些元素的氢化物中,水溶液碱性最强的是__________(写化学式);
(3)XW2的电子式为__________;
(4)Y的最高价氧化物的化学式为__________;
(5)W和Y形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为__________。
正确答案
(1)三,VA族;
(2)NH3;
(3)
(4)N2O5;
(5)S4N4
解析
由题干先推导出Z元素为磷元素,则X、Y、W分别是C、N、S。(3)小题的电子式教材中没有,得由二氧化碳的结构类比而来。(5)小题中计算为N(S):N(N)=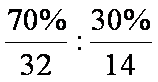
知识点
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,
得到Ce(OH)4和硫酸铁铵:
已知:
ⅰ,酸性条件下,铈在水溶液中有



ⅱ。CeO2不溶于稀硫酸
ⅲ,硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂C的是 ( )
A,NaClO B,H2O2 C,KMnO4 D,浓硫酸
(2)操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是: 。
(3)反应①之前先要洗涤滤渣B,其目的是为了除去 (填离子符号)。
(4)写出反应①的化学方程式 。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
若滴定时所用定量仪器的最小刻度为 ;所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
正确答案
(1)B
(2)冷却结晶 取样于试管中加入NaOH溶液,加热,在试管口置一湿润的红色石蕊试纸
(3)Fe3+ 、Fe2+
(4)2CeO2+ H2O2 + 3H2SO4 → Ce2(SO4)3 + O2↑+ 4H2O
(5),0.1ml;偏大
(6)Fe2(SO4) 3·2(NH4) 2SO4·2H2O
解析
略
知识点
扫码查看完整答案与解析