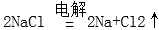- 复杂化学式的确定
- 共54题
2. NA表示阿伏加德罗常数,下列有关叙述正确的是( )
①1mol苯乙烯中含有的碳碳双键数为4NA
②6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA
③3.4gNH3中含N—H键数目为0.2NA
④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同
⑤常温下4.6gNO2和N2O4混合气体中所含原子总数为3NA
⑥等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1
⑦1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
⑧高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
正确答案
解析
①苯环不是单双键交替的结构,即苯环中不含双键,故1mol苯乙烯中含1mol双键,即NA个,故错误;
②6.2g氧化钠的物质的量为0.1mol,含有0.2mol钠离子、0.1mol阴离子,总共含有0.3mol离子;7.8g过氧化钠的物质的量为0.1mol,含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol离子,二者的混合物中含有0.6mol离子,含有的离子总数为0.6NA,故正确;
③3.4g氨气的物质的量为:
④浓度越大水解程度越小,1L 0.50mol•L-1 NH4Cl溶液与2L 0.25mol•L-1 NH4Cl溶液含NH4+物质的量后者小,故错误;
⑤NO2和N2O4的最简式均为NO2,故4.6g混合物中含有的NO2的物质的量为0.1mol,故含0.1mol氮原子即NA个,故正确;
⑥盐酸为强电解质,溶液中完全电离,1mol/L的盐酸中含有氢离子浓度为1mol/L,而磷酸为弱电解质,1mol/L的磷酸溶液中氢离子浓度小于3mol/L,所以电离出的氢离子数之比小于3:1,故错误;
⑦1mol铁与氯气完全反应生成1mol氯化铁,需要消耗1.5mol氯气,显然氯气不足,二者完全反应失去了2mol电子,失去的电子数为2NA,故错误;
⑧由

考查方向
解题思路
①、苯环不是单双键交替的结构;
②过氧化钠中阴离子为过氧根离子,氧化钠与过氧化钠的物质的量都是0.1mol氧化钠和0.1mol过氧化钠中含有0.6mol阴阳离子;
③氨气分子中含有3个氮氢键,3.4g氨气的物质的量为0.2mol,含有0.6mol氮氢键;
④浓度越大水解程度越小;
⑤NO2和N2O4的最简式均为NO2;
⑥磷酸为弱电解质,不能完全电离出氢离子;
⑦先判断铁与氯气过量情况,然后根据不足物质的物质的量计算出转移的电子数;
⑧
易错点
⑤中发现不了二者最简式相同较易判断成无法计算⑥中易由磷酸中氢的浓度大易判断成其电离出的氢离子浓度大⑦中易忽视判断氯气的量不足导致判断错误。
知识点
12.常温下 0.1mol/L的H2A溶液中H2A、HA—、A2— 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。下列表述不正确的是( )
正确答案
解析
从图可以看出,随着pH的增大,H2A先转变为HA-,再转变为A2-,即H2A的电离分两步进行即①H2A

A选项H2A


B选项NaHA=Na+ + HA- ,HA-

C选项已知25℃时HF的 Ka=10-3.45 ,而H2A的K1=10-1.2 和 K2=10-4.2 可知酸性H2A>HF>HA- 其将少量H2A的溶液加入足量NaF溶液中,发生的反应为:H2A+F﹣═ HF+HA﹣ 是正确
D选项HA-即能水解又能电离,A2-能水解,而且A2-的水解程度大于HA-的水解程度,故将相同物质的量的NaHA和Na2A固体溶于水后,HA-和A2-的浓度不再相等,故溶液的pH 不等于4.2,错误
本题正确答案是D
考查方向
本题考查离子浓度大小比较,电离平衡常数,属于综合性试题的考查,对学生的思维能力提出了较高的要求,该题的关键是在明确反应原理的基础上利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒,然后结合图象和题意灵活运用即可,难度中等
解题思路
从图可以看出,随着pH的增大,H2A先转变为HA-,再转变为A2-,即H2A的电离分两步进行即①H2A

A选项H2A


B选项NaHA=Na+ + HA- ,HA-

C选项已知25℃时HF的 Ka=10-3.45 ,而H2A的K1=10-1.2 和 K2=10-4.2 可知酸性H2A>HF>HA- 其将少量H2A的溶液加入足量NaF溶液中,发生的反应为:H2A+F﹣═ HF+HA﹣ 是正确
D选项HA-即能水解又能电离,A2-能水解,而且A2-的水解程度大于HA-的水解程度,故将相同物质的量的NaHA和Na2A固体溶于水后,HA-和A2-的浓度不再相等,故溶液的pH 不等于4.2,错误
A选项不正确,B选项不正确,C选项不正确,所有选D选项。
易错点
1、守恒关系,即电荷守恒、物料守恒以及质子守恒,然后结合图象和题意灵活运用.
2、弱电解质的电离平衡常数的计算
知识点
5.下表中的实验操作能达到实验目的的是( )
正确答案
解析
A.碳与浓硫酸反应生成的二氧化碳、二氧化硫均能使石灰水变浑浊,则不能说明二氧化碳的存在,应先检验二氧化硫并排除二氧化硫的干扰,A错误;
B.溴乙烷与NaOH的乙醇溶液共热发生消去反应,生成乙烯气体,将产生的气体直接通入到酸性高锰酸钾溶液中,溶液褪色,乙醇也可以使酸性高锰酸钾溶液褪色,不能证明溴乙烷的消去反应有乙烯生成,B错误;
C.先滴入Ba(NO3)2溶液,产生沉淀,加入足量稀盐酸,仍有沉淀,可能含有亚硫酸根,被氧化成硫酸根离子,不能用于检验溶液中是否含有SO42-,C错误;
D.等浓度的HCl与CH3COOH,HCl完全电离,电离出的氢离子浓度大,所以pH小,D正确。
故选D。
考查方向
解题思路
A.碳与浓硫酸反应生成的二氧化碳、二氧化硫均能使石灰水变浑浊;
B.乙醇也可以使酸性高锰酸钾溶液褪色;
C.先滴入Ba(NO3)2溶液,产生沉淀,加入足量稀盐酸,仍有沉淀,可能含有亚硫酸根;
D.等浓度的HCl与CH3COOH,HCl完全电离,电离出的氢离子浓度大。
易错点
本题考查化学实验方案的评价,涉及卤代烃的消去反应及水解产物、沉淀的生成、pH的比较、气体的检验及物质的性质,注重基础知识的考查,选项B为解答的难点,题目难度中等。
知识点
7.下列说法不正确的是()
正确答案
解析
c(H+)水=10-14/0.1 =10-13mol.L-1<10-7,A选项正确。
碳酸氢钠溶液显碱性,因此NaHCO3溶液中HCO3-的水解程度大于其电离程度,B正确。
溶度积常数只受温度影响,温度不度KSP不变,C正确。
在冰醋酸中加入水,醋酸的电离程度是逐渐增大的,D错误。
考查方向
解题思路
结合选项分析,涉及到离子浓度大小判断,利用好三个守恒。弱电解质稀释过程中则要注意电离程度是溶液越稀越大,而导电性则是与离子浓度大小密切相关。
易错点
离子大小判断、稀释对弱电解质电离程度的影响。
知识点
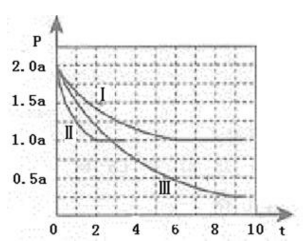
清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。Ⅰ、一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)⇌CH3OH(g)△H=﹣105kJ•mol﹣1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如右图中Ⅰ、Ⅱ、Ⅲ曲线所示:
21.Ⅱ和Ⅰ相比,改变的反应条件是 .
22.反应Ⅰ在6min时达到平衡,在此
23.反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)= .
24.比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),判断的理由是 .Ⅱ、甲烷和甲醇可以做燃料电池,具有广阔的开发和应用前景,回答下列问题
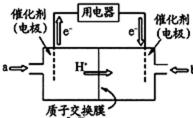
25.甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如右图所示:通入a气体的电极是原电池的 极(填“正”或“负”),其电极反应式为 。
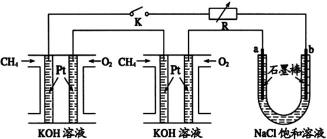
26.某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示U形管中氯化钠溶液的体积为800ml。闭合K后,若每个电池甲烷用量均为0.224L(标况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F=9.65×104C/mol),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 。
正确答案
(1)加入催化剂
正确答案
(2)0.125mol/(L· min)
正确答案
(3)12
正确答案
(4)>、 Ⅰ和Ⅲ相比,Ⅲ平衡时的体系压强更低,说明平衡向正反应方向,△H<0,只有降低温度才能达到要求,故Ⅲ时温度更低。
正确答案
(5)负、CH3OH – 6e- + H2O = CO2 + 6H+
正确答案
(6)1.544×104C 、13.3
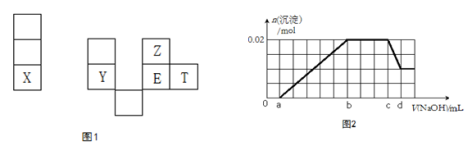
X、Y、Z、E、T均为短周期元素,在周期表中的相对位置如图1。X是短周期中原子半径最大的元素; X、Y在同一周期,Y是常见的半导体材料; E的最高价氧化物对应水化物有强脱水性。
根据判断出的元素回答问题:
7. T在元素周期表中的位置________________;
8.这几种元素的氢化物中,水溶液酸性最强的是__________ (填化学式); YZ2 的熔点__________EZ2 的熔点(填高于或低于);
9.E2T2 的电子式__________;
10.工业上制备单质X的化学反应方程式____________________;
11.已知
12.某溶液中可能含有以下阳离子(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Al3+,现取100mL该溶液逐滴滴加NaOH溶液,测得沉淀的物质的量与NaOH溶液的体积关系如上图2所示。
①在实验中,NaOH溶液滴至b~c段过程中发生的离子反应方程式为____________________;
②NaOH溶液的浓度为__________mol·L-1 (用字母c、d表示);
③原溶液中含有的Mg2+、Al3+、H+,其物质的量之比n(Mg2+):n(Al3+):n(H+)为__________。
正确答案
3ⅦA
解析
依题意X为短周期中半径最大的元素可知,据元素周期律X为第三周期元素Na;据Y在第三周期且为半导体材料,Y为Si;浓硫酸具有脱水性,故E为S,与E相邻元素Z为O,T为Cl;故:
S元素原子结构示意图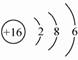
考查方向
解题思路
熟记周期表中前20号元素,通过元素周期律和常见元素及其化合物的特性推导出各个元素。
易错点
电子式书写,溶沸点比较,热化学方程式书写要点。
正确答案
HCl;高于
解析
氢化物分别为:NaH、SiH4、H2O、H2S、HCl,只有H2S、HCl水溶液显酸性,前者为弱酸,后者为强酸,故酸性最强者为HCl。另外SiO2为原子晶体,SO2为分子晶体,熔点:原子晶体>分子晶体,即熔点:SiO2>SO2。
考查方向
解题思路
熟记周期表中前20号元素,通过元素周期律和常见元素及其化合物的特性推导出各个元素。
易错点
电子式书写,溶沸点比较,热化学方程式书写要点。
正确答案
解析
根据S最外层6个电子(需共用2对电子),Cl最外层7个电子(需共用1对电子),故S2Cl2电子式为:
考查方向
解题思路
熟记周期表中前20号元素,通过元素周期律和常见元素及其化合物的特性推导出各个元素。
易错点
电子式书写,溶沸点比较,热化学方程式书写要点。
正确答案
解析
工业一般采用电解熔融NaCl制取钠:2NaCl2Na+Cl2↑
考查方向
解题思路
熟记周期表中前20号元素,通过元素周期律和常见元素及其化合物的特性推导出各个元素。
易错点
电子式书写,溶沸点比较,热化学方程式书写要点。
正确答案
Si(s)+O2(g)═SiO2(s) ΔH=-989.2 kJ·mol―1
解析
Si(s)+O2(g)═SiO2(s) ΔH=-989.2 kJ·mol―1(注意物质的状态,ΔH的正负号及数值与系数统一)
考查方向
解题思路
熟记周期表中前20号元素,通过元素周期律和常见元素及其化合物的特性推导出各个元素。
易错点
电子式书写,溶沸点比较,热化学方程式书写要点。
正确答案
①Fe3+;
② NH4+ + OH-= NH3·H2O;10/(d-c) mol·L-1
③1:1:1
解析
①由图2可知oa段未产生沉淀,说明原溶液中有H+,再据ab段产生沉淀,cd段之后沉淀未完全消失,说明ab段生成了2种沉淀,故含Mg2+和Al3+( 生成了氢氧化镁和氢氧化铝沉淀,cd段溶解了氢氧化铝),另bc段沉淀不增加也不减少,说明还含NH4+( bc段离子反应:NH4++OH_=NH3.H2O);由图2纵坐标可知Al(OH)3和Mg(OH)2两者沉淀之和为0.02mol(其中当沉淀Al(OH)3溶解后还剩下沉淀Mg(OH)20.01mol),说明Al(OH)3为0.01mol,因为cd段反应:Al(OH)3+NaOH=NaAlO2+2H2O,故n(NaOH)=0.01mol,C (NaOH)= 10/(d-c) mol·L-1。
②结合①分析并由图2信息V(NaOH)oa = V(NaOH)cd可知,n(Mg2+)= n(Al3+)= n(H+)=0.01mol,即n(Mg2+):n(Al3+):n(H+)=1:1:1。
考查方向
解题思路
熟记周期表中前20号元素,通过元素周期律和常见元素及其化合物的特性推导出各个元素。
易错点
电子式书写,溶沸点比较,热化学方程式书写要点。
5.室温下,0.1 mol·L−1 NaHCO3溶液的pH = 8.31,有关该溶液的判断正确的是( )
正确答案
解析
A.室温下,0.1mol•L-1NaHCO3溶液的pH=8.31,溶液呈碱性,说明HCO3-的水解程度大于电离程度,但其电离和水解程度都较小,水电离也生成氢氧根离子,钠离子不水解,所以离子浓度大小顺序是
c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),故A错误;B.Ka1(H2CO3)•Ka2(H2CO3)=c(H+).c(HCO3−)/C(H2CO3).c(H+).c(CO32−)/c(HCO3−),碳酸和碳酸氢根离子都部分电离,所以c(H+).c(HCO3−)/C(H2CO3)<c(H+),c(H+).c(CO32−)/c(HCO3−)<c(H+),因为室温下纯水中,c(OH-)=c(H+),所以Ka1(H2CO3)•Ka2(H2CO3)<KW,故B正确;C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),故C错误;D.任何电解质溶液中都存在物料守恒,未加NaOH时,根据物料守恒c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-),加入NaOH溶液时则存在c(Na+)>c(H2CO3)+c(HCO3-)+c(CO32-),故D错误
考查方向
解题思路
A.室温下,0.1mol•L-1NaHCO3溶液的pH=8.31,溶液呈碱性,说明HCO3-的水解程度大于电离程度,但其电离和水解程度都较小,水电离也生成氢氧根离子;
B.Ka1(H2CO3)•Ka2(H2CO3)=c(H+).c(HCO3−)/C(H2CO3).c(H+).c(CO32−)/c(HCO3−)
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
易错点
对溶液中离子浓度判断不清
知识点
1.下列溶液中,c( Cl- )与50mL 1mol/L AlCl3溶液中c(Cl- )相等的是( )
正确答案
解析
100mL 1mol/L AlCl3溶液中Cl-物质的量浓度是3mol/L,Cl-物质的量为3mol/L×0.1L=0.3mol A、150mL 1mol/L氯化钠溶液中c(Cl-)=1 mol/L×1=1mol/L,Cl-物质的量为1mol/L×0.15L=0.15mol,A错误;B、75mL 2mol/L氯化镁溶液中c(Cl-)=2mol/L×2=4mol/L,Cl-物质的量为2mol/L×0.075L×2=0.3mol,B错误;C、100mL 1mol/LKCl溶液中氯离子的物质的量浓度=1mol/L×1=1mol/L ,C错误;故D正确
考查方向
解题思路
物质的量浓度(cB)=物质的量(n)/溶液的体积(V),50mL1mol/L的AlCl3溶液中的Cl-浓度为3mol/L,根据溶质化学式计算各选项中的Cl-物质的量,进行比较可知.注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.
易错点
对物质的电离与水解掌握不牢固
知识点
2、用NA表示阿伏加德罗常数,下列叙述中不正确的是( )
①32 g S8单质(S8分子结构如右图)中含有的S—S键个数为NA
②电解精炼铜时转移了NA个电子,阳极溶解32 g铜
③7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA
④2 mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA
⑤2.9 g熟石膏(2CaSO4·H2O)含有的结晶水分子数为0.02 NA (2CaSO4·H2O式量为290)
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
正确答案
解析
:①一个S8分子(其“皇冠”结构如图)中含有的S-S键个数为8个,32gS8单质物质的量=32g/8×32g/mol=0.125mol,含有的S-S键个数为NA,故正确;②电解精炼铜时转移了NA个电子,电子的物质的量为1mol,阳极的粗铜中含有铁锌等杂质,活泼性均大于铜的,所以电解时先失去电子,所以转移0.5mol电子,阳极溶解的铜的物质的量小于0.5,质量小于32g,故错误;③1mol过氧化钠中含有1mol阴离子,7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA,故错误;④可逆反应不能进行彻底,2molSO2和1molO2,混合气体在催化剂作用下反应容器中物质分子数大于2NA,故正确;⑤2.9g 2CaSO4•H2O物质的量=0.01mol,含有的结晶水分子数为0.01NA,故错误;⑥随着反应进行,硫酸浓度降低,不再与铜反应,所以生成SO2的分子数小于0.1NA.故错误;故选:C.
考查方向
解题思路
】①一个S8分子(其“皇冠”结构如图)中含有的S-S键个数为8个;②根据粗铜中含有摩尔质量比铜小且活泼性比铜大的杂质分析;③硫化钠和过氧化钠的摩尔质量相等,1mol过氧化钠中含有1mol阴离子;④二氧化硫和氧气反应是可逆反应不能进行彻底;⑤质量换算物质的量结合化学式计算;⑥只有浓硫酸与铜反应,稀硫酸与铜不反应.
易错点
阿伏加德罗常数的有关计算和判断
知识点
7.用AG表示溶液的酸度,AG = lg[c(H+)/c(OH-)]。室温下实验室中用0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定结果如图所示。下列有关叙述正确的是( )
正确答案
解析
A.加入10.00 mL NaOH溶液时,CH3COOH与NaOH后,NaOH过量,得到NaOH和CH3COONa的物质的量为1:1混合溶液,在此混合溶液中存在电荷守恒:c(H+) + c(Na+) = c(CH3COO-) + c(OH-),但是溶液中c(Na+)<CH3COOH,所以c(H+) + c(CH3COOH) >c(CH3COO-) + c(OH-),错误
B.A点时AG=0,则c(H+)=c(OH-),溶液显中性,由于醋酸是弱酸,二者的浓度相等,所以加入氢氧化钠溶液体积为20mL,恰好中和,则吃剩的盐水解是溶液显碱性,所以A点时加入氢氧化钠溶液体积小于20 mL,错误;
C.若B点时加入NaOH溶液40 mL,则所得溶液是CH3COOH和CH3COONa的等物质的量的混合溶液。根据物料守恒可得c(Na+)=2c(CH3COO-)+2c(CH3COOH);所以C错误;
D.在开始时溶液的AG=7,c(H+)/c(OH-)=107;c(H+)·c(OH-)=10-14;则c(H+)=3.3×10-3,所以在室温时0.01 mol·L-1的醋酸溶液pH=3.5,正确;
考查方向
解题思路
A.根据A点的溶质的成分以及不能用电荷守恒进行判断;
B.根据A点时,AG=0,即c(H+)/c(OH-)=1来分析;
C加入NaOH溶液40 mL,得等浓度的CH3COONa和NaOH的混合溶液,根据溶液的电荷守恒和物料守恒来分析;
D.根据开始时溶液的AG=7,以及AG = lg[c(H+)/c(OH-)]进行计算。
易错点
A.不能判断出加入10.00 mL NaOH溶液时溶液中溶质的成分以及不能用电荷守恒进行判断;
B.不能判断出A点的离子浓度;
C.不能熟练使用物料守恒;
D.pH计算能力欠佳。
知识点
扫码查看完整答案与解析