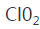- 氯气的化学性质
- 共34题
8. I.已知C1O2是易溶于水难溶于有机溶剂的气体,常用于自来水消毒。实验室制备C1O2是用亚氯酸钠固体与氯气反应:2NaClO2+C12=2C1O2+2NaCl,装置如下图所示:
(1)烧瓶内可发生的反应的化学方程式:________________________。
(2)B、C、E装置中的试剂依次为____________________
a、NaOH溶液
b、浓硫酸
c、饱和食盐水
d、CCl4
e、饱和石灰水
(3)以下装置既能吸收尾气又能防止倒吸的是_____________
II.用C1O2处理后的自来水中,C1O2的浓度应在0.10~0.80mg·L-1之间。用碘量法检测水中C1O2浓度的实验步骤如下:取100mL的水样加稀硫酸调节pH至1~3,加入一定量的碘化钾溶液,振荡,再加入少量指示剂后,用1.0×10-4mol·L-1的Na2S
(4)加入的指示剂是___________,达到滴定终点时的现象是___________________________________________
(5)碘化钾反应的离子方程式是________________________________。
(6)已知滴定终点时,消耗Na2S2O3溶液16.30mL,则水样中C1O2的浓度是____mg·L-1。
正确答案
(1)MnO2+4HCl(浓)
(2)c b d
(3)②③⑤
(4)淀粉溶液,滴入最后一滴Na2S2O3溶液后,溶液的蓝色变为无色(或蓝色褪去),半分钟内不恢复原来的颜色
(5)2ClO2 +8H++ 10I- = 2Cl- +4H2O +5I2
(6)0.22
解析
I.(1)由实验装置图可见,烧瓶内制取氯气,发生的反应的化学方程式:MnO2+4HCl(浓)
(2)B装置用于吸收挥发出来的氯化氢气体,瓶内的试剂是c饱和食盐水、C装置用于干燥氯气,瓶内的试剂是b浓硫酸、E装置用于吸收未参加反应的氯气,试剂是d CCl4;
(3)ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸,导气管不能插入到液面以下,装置①④可以引起倒吸,②③⑤既能吸收尾气又能防止倒吸;
II.(4)检验氧化生成的单质碘,加入的指示剂是淀粉溶液,达到滴定终点时的现象是滴入最后一滴Na2S2O3溶液后,溶液的蓝色变为无色(或蓝色褪去),半分钟内不恢复原来的颜色;
(5)二氧化氯将碘离子氧化生成单质碘,根据得失电子平衡,反应的离子方程式是2ClO2 +8H++ 10I- = 2Cl- +4H2O +5I2;
(6)2ClO2 +8H++ 10I- = 2Cl- +4H2O +5I2 2S2O32-+I2=S4O62-+2I-,
因此:ClO2 ~ ~~~~ ~~~5S2O32-
1 5
x 1.0×10-4mol·L-1×16.30mL

则水样中C1O2的浓度是3.26×10-4mmol×10×67.5=0.22mg·L-1。
考查方向
解题思路
I.(1)由实验装置图可见,烧瓶内制取氯气;
(2)B装置用于吸收挥发出来的氯化氢气体,瓶内的试剂是c饱和食盐水、C装置用于干燥氯气,瓶内的试剂是b浓硫酸、E装置用于吸收未参加反应的氯气,试剂是d CCl4;
(3)ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸,导气管不能插入到液面以下,装置①④可以引起倒吸,②③⑤既能吸收尾气又能防止倒吸;
II.(4)检验氧化生成的单质碘,加入的指示剂是淀粉溶液,达到滴定终点时的现象是滴入最后一滴Na2S2O3溶液后,溶液的蓝色变为无色(或蓝色褪去),半分钟内不恢复原来的颜色;
(5)二氧化氯将碘离子氧化生成单质碘,根据得失电子平衡,反应的离子方程式是2ClO2 +8H++ 10I- = 2Cl- +4H2O +5I2;
(6)2ClO2 +8H++ 10I- = 2Cl- +4H2O +5I2 2S2O32-+I2=S4O62-+2I-,
因此:ClO2 ~ ~~~~ ~~~5S2O32-
1 5
x 1.0×10-4mol·L-1×16.30mL

则水样中C1O2的浓度是3.26×10-4mmol×10×67.5=0.22mg·L-1。
易错点
本题考查气体的制备、除杂、收集等实验操作,题目难度不大,学习中注意把握化学实验基本操作,做该类题目时把握实验目的和实验原理是解答题目的关键。
知识点
11.【化学——选修2:化学与技术】
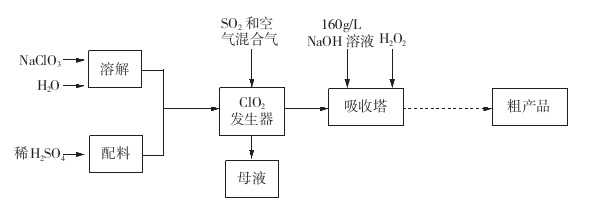
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2•3H2O;②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)发生器中发生反应的离子方程式为 。发生器中鼓入空气的作用可能是 。
a.将SO2氧化成SO3,增强酸性
b.将NaClO3还原为ClO2
c.稀释ClO2以防止爆炸
(2)吸收塔内发生反应的化学方程式为 ;吸收塔内的温度不能超过20℃,其目的是 。
(3)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。以下还可以选择的还原剂是 (选填序号)。
a.Na2O2
b.Na2S
c.FeCl2
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是_____________________。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 ml待测溶液。
(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00 ml待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V ml 。(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为 。
②该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,结果化成最简。)
正确答案
(1)2ClO3-+SO2=2ClO2↑+SO42- ; c
(2)2NaOH+2ClO2+H2O2=2NaClO2+2 H2O+O2↑(2分); 防止H2O2分解
(3)a
(4)蒸发浓缩、冷却结晶、过滤
(5)①滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色 ②22.625cV/m %(2分)
解析
考查方向
解题思路
物质分离是常考内容,抓住物质的物理性质和化学性质特征,选择合适的分离方法。常见物质分离提纯的10种方法:
1.结晶和重结晶:利用物质在溶液中溶解度随温度变化较大,如NaCl,KNO3
2.蒸馏冷却法:在沸点上差值大。乙醇中(水):加入新制的CaO吸收大部分水再蒸馏。
3.过滤法:溶与不溶。
4.升华法:SiO2(I2)。
5.萃取法:如用CCl4来萃取I2水中的I2。
6.溶解法:Fe粉(A1粉):溶解在过量的NaOH溶液里过滤分离。
7.增加法:把杂质转化成所需要的物质:CO2(CO):通过热的CuO; CO2(SO2):通过NaHCO3溶液。
8.吸收法:除去混合气体中的气体杂质,气体杂质必须被药品吸收:N2(O2):将混合气体通过铜网吸收O2。
9.转化法:两种物质难以直接分离,加药品变得容易分离,然后再还原回去:Al(OH)3,Fe(OH)3:先加NaOH溶液把Al(OH)3溶解,过滤,除去Fe(OH)3,再加酸让NaAlO2转化成A1(OH)3。
易错点
1、工艺流程图的分析。
2、酸碱中和滴定的计算。
知识点
2.下列表示物质变化的式子错误的是()
正确答案
解析
A.氯气通入水中反应的离子方程式为:Cl2+H2O 
B.甲烷的完全燃烧是放热反应,CH4(g)+2O2(g) 
C.冰醋酸是弱酸,加入水中电离的方程式为:CH3COOH+H2O 
D.铁与水蒸气反应生成四氧化三铁和氢气, 3Fe+4H2O
故选D。
考查方向
解题思路
A.氯气通入水中反应的离子方程式为:Cl2+H2O 
B.甲烷的完全燃烧是放热反应;
C.冰醋酸是弱酸,加入水中电离的方程式为:CH3COOH+H2O 
D.铁与水蒸气反应生成四氧化三铁和氢气。
易错点
本题考查离子反应、热化学方程式、化学方程式的书写,明确发生的化学反应是解答本题的关键,题目难度中等。
知识点
12.某兴趣小组用下图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )
正确答案
A
解析
A、饱和食盐水用于除HCl杂质,浓硫酸用于干燥气体,氯气用长进短出收集;
B、NO无法用NaOH吸收处理。
C、饱和碳酸钠溶液要和二氧化碳反应,应使用饱和碳酸氢钠除杂。
D、氢气密度小于空气不能用5中装置下进上出收集。
考查方向
本题主要考查了实验装置的作用;基本实验操作;实验尾气的处理。
解题思路
A、饱和食盐水用于除HCl杂质,浓硫酸用于干燥气体,氯气用长进短出收集;
B、NO无法用NaOH吸收处理。
C、饱和碳酸钠溶液要和二氧化碳反应。
D、5中氢气密度小于空气不能用下进上出收集。
易错点
1. 饱和碳酸钠溶液要和二氧化碳反应。
2. NO无法用NaOH吸收处理
知识点
亚氯酸钠( NaCl02)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等。已知:NaClO2饱和溶液在温度低于38
28.
a.将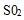
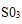
b.稀释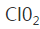
c.将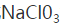
29.吸收塔内反应的化学方程式为 ,吸收塔的温度不能超过20℃,其原因是____。
30.从“母液”中可回收的主要物质是 。
31.从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:
①减压,55℃蒸发结晶;
②_______________;
③ ___________________;
④低于60℃干燥,得到成品。
从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体; 从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:
①减压,55℃蒸发结晶;
②过滤;
③38-60℃温水洗涤;
④低于60℃干燥,得到成品。
正确答案
2ClO3-+SO2=2ClO2↑+SO42- b
解析
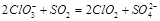
考查方向
本题主要考查了物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计。
解题思路
ClO3-中氯元素为+5价做氧化剂, SO2具有还原性。
易错点
本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点。
正确答案
2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑,防止H2O2分解
解析
吸收塔中发生的是二氧化氯与氢氧化钠、过氧化氢发生反应生成亚氯酸钠(NaClO2),Cl元素的化合价降低,则过氧化氢中的O元素的化合价升高,所以产物在还有氧气生成,根据元素守恒可知产物中有水生成,所以化学方程式是2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;过氧化氢受热易分解,所以吸收塔的温度不能超过20℃;
考查方向
本题主要考查了物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计。
解题思路
吸收塔中发生的是二氧化氯与氢氧化钠、过氧化氢发生反应生成亚氯酸钠(NaClO2),Cl元素的化合价降低,则过氧化氢中的O元素的化合价升高;过氧化氢受热易分解;
易错点
本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点。
正确答案
Na2SO4
解析
从“母液”中可回收的主要物质是Na2SO4;
考查方向
本题主要考查了物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计。
解题思路
从“母液”中可回收的主要物质是Na2SO4;
易错点
本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点。
正确答案
过滤;38-60℃温水洗涤
解析
从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体; 从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:
①减压,55℃蒸发结晶;
②过滤;
③38-60℃温水洗涤;
④低于60℃干燥,得到成品。
考查方向
本题主要考查了物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计。
解题思路
从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体; 从吸收塔中可获得NaCl02溶液。
易错点
本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点。
正确答案
74.21%
解析
因为是用Na2S203标准液滴定到终点,反应是I2+2S2O32-= 2I-+S4O62-,,I2与指示剂淀粉产生蓝色,故由反应中I元素守恒可知,ClO2-----2I2---- S4O62-25.00 mL待测液计算出n(NaClO2);再计算出m(NaClO2)样品中该样品中NaClO2的质量分数为74.21%。
考查方向
本题主要考查了物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计。
解题思路
因为是用Na2S203标准液滴定到终点,反应是I2+2S2O32-= 2I-+S4O62-,,由反应中I元素守恒,ClO2-----2I2---- S4O62-计算。
易错点
本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点。
扫码查看完整答案与解析