- 化学方程式的有关计算
- 共13题
在常压和500℃条件下,等物质的量的Ag2O、Fe(OH)3、NH4HCO3、NaHCO3完全分解,所得气体体积依次为V1、V2、V3、V4,体积大小顺序正确的是
正确答案
解析
常压和500℃条件下,水是气体,等物质的量的Ag2O,Fe(OH)3 ,NH4HCO3 ,NaHCO3完全分解,根据分解化学方程式可知:生成的气体体积大小顺序为V3>V4>V2>V1。
知识点
硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.7700g样品,配制成100ml溶液A 。②准确量取25.00 ml溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g 。③准确量取25.00 ml溶液A,加入适量稀硫酸酸化后,用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 ml。H2O2与KMnO4反应的离子方程式如下:
2MnO4―+5H2O2+6H+=4Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥ mol·L-1。
(2)上述滴定不加稀硫酸酸化,MnO4―被还原成MnO2,其离子方程式为:
。
(3)通过计算确定样品的组成(写出计算过程)。
正确答案
见解析。
解析
(1)n(BaSO4)=0.5825g/233 g·mol-1=2.50×10-3 mol
(2)2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(3)n(H2O2)=5/2·(0.0200mol· L-1×25.00 mL)/1000mL· L-1=1.25×10-3 mol
m(Na2SO4)=142g·mol-1×2.50×10-3mol=0.355g
m(H2O2)=34g·mol-1×1.25×10-3mol=0.0425g
n(H2O)=[(1.7700g×25.00mL/100 mL)-0.355g-0.0425g]/18 g·mol-1
=2.5×10-3 mol
x:y:z=n(Na2SO4):n(H2O2):n(H2O)=2:1:2
硫酸钠-过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O
本题属于物质组成分析与化学综合计算题。利用氧化还原反应滴定进行成分析,运用元素守恒进行推理计算,兼有溶度积常计算,离子方程式书写。
知识点
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠___g。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。
(i)计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
(ii)计算并确定该钠-钾合金的化学式。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O
己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
正确答案
见解析。
解析
(1) 78 ;
(2)
(i)c(OH-)=
(ii)设上述合金中含amolNa、bmolK, a+b=0.75×2 23a+39b=5.05
a=0.050mol b=0.10mol,该钠-钾合金化学式为NaK2
(3)溶液含NaOH,NaOH与CO2反应生成的Na2CO3:15-
112LCO2的物质的量:112/22.4=5(mol) n[Al(OH)3]:n(Na2CO3)=[(5-3)×2]:5=4:5。
(4)由NaCl质量推算,氢氧化钠样品摩尔质量为:
M1(NaOH)=
M2(NaOH)=
M2(NaOH)=
结论:实验①所取氢氧化钠样品是NaOH;实验②和③所取氢氧化钠样品应该是NaOH·H2O。
本题以元素化合物为载体命题,意在考查考生的计算能力和分析、推理能力。
(1)利用“N”守恒可知需m(NaN3)=(40.32L/22.4L·mol-1)×2/3×65g·mol-1=78g。
(2)①由反应方程式可知产生1molH2同时生成2molOH-,故c(OH-)=(0.075mol×2)/0.2L=0.75mol/L;②设合金中Na、K的物质的量分别为amol、bmol,然后利用质量守恒与得失电子守恒可得方程式:a+b=0.75×2 和23a+39b=5.05,解之得a=0.050mol、b=0.10mol,故可得到合金的化学式为NaK2。
(3)若溶液中仅含NaAl(OH)4,利用方程式可知得到24molAl(OH)3的同时生成12molNa2CO3,而实际得到24molAl(OH)3与15molNa2CO3,说明溶液中含有NaOH,且NaOH优先与CO2反应生成Na2CO3,利用Na守恒知溶液中n(NaOH)=(15-12)mol×2=6mol,故通入112LCO2(5mol)先与NaOH作用消耗CO23mol生成3mol Na2CO3,然后2molCO2与NaAl(OH)4作用得到4molAl(OH)3和2mol Na2CO3,故生成n[Al(OH)3]:n(Na2CO3)=4:(3+2)=4:5。
(4)由NaOH+HCl=NaCl+H2O可知溶液PH=7时,二者恰好反应,故三次实验得到的固体均为纯净的氯化钠,故利用“钠守恒”得m(NaCl)/M(NaCl)=m(氢氧化钠样品)/M(氢氧化钠样品),利用该式和题中数据可计算出三次实验中所取氢氧化钠样品的摩尔质量,进而可得出结论。
知识点
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下:
(1)在“还原焙烧”中产生的有毒气体可能有_________。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是_________(用离子方程式表示)。
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于_________,检验Fe3+已经除尽的试剂是_________;当pH = 5时,溶液中c(Al3+)=_________mol·L– 1(已知常温下Ksp[Al(OH)3] = 2.0×10– 33)。
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是_________。
(5)a g烧渣经过上述工艺可得红氧化铁b g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于_________(用含a、b的表达式表示)。
正确答案
(1)CO和SO2等(写出一个合理答案也给分)
(2)4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O
(3)7.11;KSCN(溶液);2.0×10– 6
(4)洗涤、干燥(只写洗涤也给分)
(5)
解析
略。
知识点
水资源与我们的生产、生活息息相关。
(1)硬水软化常用离子交换法。NaR型离子交换树脂使用一段时间后,逐渐失去交换能力,将树脂置于________中浸泡一段时间即可再生。当洗涤用水硬度较大时,洗衣粉与肥皂相比洗涤效果更好,其原因是________。
(2)生活污水常含有大量的含氮化合物,可用生物膜脱氮工艺进行处理。首先在硝化细菌的作用下将NH4+氧化成NO3-,其原理为:aNH4++bO2=cH++dNO3-+eH2O,反应化学方程式中b=________;该过程需要控制水温为20℃~36℃,其原因是________。硝化后加入甲醇与NO3-生成N2,该过程中甲醇的作用是________。
(3)镀铜废水中含有Cr2O72-,常加入Na2S2O3进行处理后排放,该处理过程使用的方法是________。加入Na2S2O3溶液之前常将废水调整至较强的酸性环境,原因是________。取少量处理后的水样于试管中,加入NaOH溶液产生蓝色沉淀,要使该蓝色沉淀溶解,除了加入酸之外,还可以加入氨水生成[Cu(NH3)4]2+,该反应的离子方程式为________。
正确答案
(1)5%~8%的食盐水;肥皂的主要成分是硬脂酸钠,电离出的硬脂酸根离子易与Ca2+、Mg2+离子结合成沉淀,而主要成分为表面活性剂的洗衣粉可以避免这种情况。
(2)2;温度过高或过低对硝化菌均有抑制作用;做还原剂
(3)氧化还原法;酸性条件下Cr2O72-氧化性更强,有利于反应的进行; Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++4H2O+2OH-
解析
略。
知识点
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:
① Na2SO4


② Na2SO4


(1)现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4)_______ g(精确到0.01);
(2)若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量n的范围是
____________<n<_____________ ;
(3)若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y
(4)Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量硫酸,充分反应后,过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各成分的物质的量分别为 ________- 。
(请写出计算过程)
正确答案
(1)15.78
(2)由反应①和②可得反应③:Na2SO4+ 2C
(3)y =(x+2)/4(1+x)
(4) n(Na2S)=0.25 mol n(Na2SO3)=0.10 mol n(Na2SO4)=0.05 mol
计算过程:2Na2S+ Na2SO3+3 H2SO4→3 Na2SO4+ 3S↓+3H2O
Na2S+ H2SO4→Na2SO4+H2S
根据以上两个反应结合题中条件可求得: 39.20 g样品中有Na2SO3: 0.10 mol Na2S:0.250mol再应用质量守恒得:Na2SO4:0.05 mol
解析
略
知识点
已知2.1克KOH和1.6克S混合后加热,恰好反应:aKOH+bS→cK2Sx+dK2S2O3+eH2O,则x的值为
正确答案
解析
略
知识点
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标)和加入铁粉的物质的量(横坐标)之间的关系如图所示,则原溶液中Fe(NO3)3、 Cu(NO3)2、HNO3物质的量浓度之比为
正确答案
解析
略
知识点
汽车尾气中的NO2已造成严重空气污染,因此盼望化学家能找到适合的化合物G与适当的反应条件,进行下列反应NO2 + G 
正确答案
解析
略
知识点
11.为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的工业原料FeSO4(反应条件略)
活化硫铁矿还原Fe2+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应,请回答下列问题:
(1)第1步H2SO4与Fe2O3反应的离子方程式是( )。
(2)检验第II步中Fe3+是否完全还原,应选择( ) (填字母编号)。
A.KMnO4溶液
B.K2[Fe(CN)4]溶液
C.KSCN溶液
(3)第III步加FeCO3调溶液pH到5.8左右,然后再第VI步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是( )。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
(5)已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) 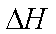
C(s)+O2(g)=CO2(g) 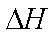
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) 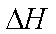
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是( )。
(6)加入烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗掉饿硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第III步应加入FeCO3 ( )kg。
正确答案
(1)Fe2O3+6H+=2Fe3++3H2O
(2)C
(3)Fe2+被氧化为Fe3+,Fe3+水解产生H+。
(4)4FeCO3(s)+O2(g) =2Fe2O3(s)+ 4CO2(g) 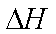
(5)FeS2+4Li++4e-= Fe+2 Li2S或FeS2+4e-= Fe +2S2-
(6)0.0118ab-0.646c或-kg。
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析




