- 化学方程式的有关计算
- 共13题
在常压和500℃条件下,等物质的量的Ag2O、Fe(OH)3、NH4HCO3、NaHCO3完全分解,所得气体体积依次为V1、V2、V3、V4,体积大小顺序正确的是
正确答案
解析
常压和500℃条件下,水是气体,等物质的量的Ag2O,Fe(OH)3 ,NH4HCO3 ,NaHCO3完全分解,根据分解化学方程式可知:生成的气体体积大小顺序为V3>V4>V2>V1。
知识点
硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.7700g样品,配制成100ml溶液A 。②准确量取25.00 ml溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g 。③准确量取25.00 ml溶液A,加入适量稀硫酸酸化后,用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 ml。H2O2与KMnO4反应的离子方程式如下:
2MnO4―+5H2O2+6H+=4Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥ mol·L-1。
(2)上述滴定不加稀硫酸酸化,MnO4―被还原成MnO2,其离子方程式为:
。
(3)通过计算确定样品的组成(写出计算过程)。
正确答案
见解析。
解析
(1)n(BaSO4)=0.5825g/233 g·mol-1=2.50×10-3 mol
(2)2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(3)n(H2O2)=5/2·(0.0200mol· L-1×25.00 mL)/1000mL· L-1=1.25×10-3 mol
m(Na2SO4)=142g·mol-1×2.50×10-3mol=0.355g
m(H2O2)=34g·mol-1×1.25×10-3mol=0.0425g
n(H2O)=[(1.7700g×25.00mL/100 mL)-0.355g-0.0425g]/18 g·mol-1
=2.5×10-3 mol
x:y:z=n(Na2SO4):n(H2O2):n(H2O)=2:1:2
硫酸钠-过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O
本题属于物质组成分析与化学综合计算题。利用氧化还原反应滴定进行成分析,运用元素守恒进行推理计算,兼有溶度积常计算,离子方程式书写。
知识点
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠___g。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。
(i)计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
(ii)计算并确定该钠-钾合金的化学式。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O
己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
正确答案
见解析。
解析
(1) 78 ;
(2)
(i)c(OH-)=
(ii)设上述合金中含amolNa、bmolK, a+b=0.75×2 23a+39b=5.05
a=0.050mol b=0.10mol,该钠-钾合金化学式为NaK2
(3)溶液含NaOH,NaOH与CO2反应生成的Na2CO3:15-
112LCO2的物质的量:112/22.4=5(mol) n[Al(OH)3]:n(Na2CO3)=[(5-3)×2]:5=4:5。
(4)由NaCl质量推算,氢氧化钠样品摩尔质量为:
M1(NaOH)=
M2(NaOH)=
M2(NaOH)=
结论:实验①所取氢氧化钠样品是NaOH;实验②和③所取氢氧化钠样品应该是NaOH·H2O。
本题以元素化合物为载体命题,意在考查考生的计算能力和分析、推理能力。
(1)利用“N”守恒可知需m(NaN3)=(40.32L/22.4L·mol-1)×2/3×65g·mol-1=78g。
(2)①由反应方程式可知产生1molH2同时生成2molOH-,故c(OH-)=(0.075mol×2)/0.2L=0.75mol/L;②设合金中Na、K的物质的量分别为amol、bmol,然后利用质量守恒与得失电子守恒可得方程式:a+b=0.75×2 和23a+39b=5.05,解之得a=0.050mol、b=0.10mol,故可得到合金的化学式为NaK2。
(3)若溶液中仅含NaAl(OH)4,利用方程式可知得到24molAl(OH)3的同时生成12molNa2CO3,而实际得到24molAl(OH)3与15molNa2CO3,说明溶液中含有NaOH,且NaOH优先与CO2反应生成Na2CO3,利用Na守恒知溶液中n(NaOH)=(15-12)mol×2=6mol,故通入112LCO2(5mol)先与NaOH作用消耗CO23mol生成3mol Na2CO3,然后2molCO2与NaAl(OH)4作用得到4molAl(OH)3和2mol Na2CO3,故生成n[Al(OH)3]:n(Na2CO3)=4:(3+2)=4:5。
(4)由NaOH+HCl=NaCl+H2O可知溶液PH=7时,二者恰好反应,故三次实验得到的固体均为纯净的氯化钠,故利用“钠守恒”得m(NaCl)/M(NaCl)=m(氢氧化钠样品)/M(氢氧化钠样品),利用该式和题中数据可计算出三次实验中所取氢氧化钠样品的摩尔质量,进而可得出结论。
知识点
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标)和加入铁粉的物质的量(横坐标)之间的关系如图所示,则原溶液中Fe(NO3)3、 Cu(NO3)2、HNO3物质的量浓度之比为
正确答案
解析
略
知识点
11.为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的工业原料FeSO4(反应条件略)
活化硫铁矿还原Fe2+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应,请回答下列问题:
(1)第1步H2SO4与Fe2O3反应的离子方程式是( )。
(2)检验第II步中Fe3+是否完全还原,应选择( ) (填字母编号)。
A.KMnO4溶液
B.K2[Fe(CN)4]溶液
C.KSCN溶液
(3)第III步加FeCO3调溶液pH到5.8左右,然后再第VI步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是( )。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
(5)已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) 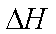
C(s)+O2(g)=CO2(g) 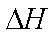
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) 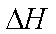
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是( )。
(6)加入烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗掉饿硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第III步应加入FeCO3 ( )kg。
正确答案
(1)Fe2O3+6H+=2Fe3++3H2O
(2)C
(3)Fe2+被氧化为Fe3+,Fe3+水解产生H+。
(4)4FeCO3(s)+O2(g) =2Fe2O3(s)+ 4CO2(g) 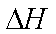
(5)FeS2+4Li++4e-= Fe+2 Li2S或FeS2+4e-= Fe +2S2-
(6)0.0118ab-0.646c或-kg。
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析


