- 常见的能量转化形式
- 共45题
8. 下列解释事实的方程式不准确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
1.在298K时,NaCl在水中的溶解度为36g/100g水。如将0.5molNaCl溶解在1L水中,此溶解过程中体系的△H-T△S和熵如何变化( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27. SO2和NOx都是大气污染物。
(1)汽车排放的尾气中含CO和NO,汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是_________________________。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知:N2(g)+O2(g) = 2NO(g)ΔH=+180.6 kJ·mol-1
C(s)+O2(g) = CO2(g)ΔH=-393.5 kJ·mol-1
则反应C(s)+2NO(g) = CO2(g)+N2(g)ΔH=________kJ·mol-1。
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为_________(填写“氧化剂”或“还原剂”)。下式中X必须为无污染的物质,系数n可以为0。
NO2+G
下列化合物中,满足上述反应式中的G是________(填写字母)。
a.NH3 b.CO2
c.SO2 d.CH3CH2OH
(4)利用氨水可以将SO2和NO2吸收,原理如下图所示:
NO2被吸收的离子方程式是________________________。
(5)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
① b极的电极反应式为__________________。
② 在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子方程式为___________________________。
正确答案
(1)2CO+2NO
(2)-574.1
(3)还原剂,ad
(4)2NO2+4HSO3- = N2+4SO42-+4H+
(5)① 2HSO3- +2e- = S2O42-+2OH-
② 4 S2O42- + 2NO2 + 8OH- = 8SO32- + N2 +4 H2O
解析
解析已在路上飞奔,马上就到!
知识点
11.常温下,浓度均为0.1mol/L的三种溶液:
①CH3COOH溶液
②NaOH溶液
③CH3COONa溶液
下列说法中不正确的是(忽略混合前后溶液体积变化)( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3 + SO2 → Na2S2O5
(1)装置I中产生气体的化学方程式为______________________________。
(2)要从装置II中获得已析出的晶体,可采取的分离方法是________。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为____(填序号)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3—的电离程度大于水解程度,可采用的实验方法是_____(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是______________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量的方案如下:
(已知:滴定时反应的化学方程式为SO2 + I2 + 2 H2O → H2SO4 + 2 HI)
按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________ g/L。
在上述实验过程中,若有部分HI被空气氧化,则测得结果________(填“偏高”、“偏低”或“不变”)。
正确答案
(1)Na2SO3 + H2SO4 → Na2SO4 + SO2↑+ H2O或Na2SO3 + 2 H2SO4 → 2 NaHSO4 + SO2↑+ H2O。
(2)分离方法是过滤。
(3)d
(4)a、e
(5)取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成。
(6)0.16 g/L;偏低
解析
解析已在路上飞奔,马上就到!
知识点
7.如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.下列解释实验现象的离子反应方程式正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.已知I、 II反应在一定条件节焓变及平衡常数如下:
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g)
(2)回答下列反应(I)的相关问题:
①温度为T1,在1L恒容容器中加入1.8mol H2、1.2mol S2, l0min时反应达到平衡。测得l0min内V(H2S)=0.08 mol·L-1·min-l,则该条件下的平衡常数为________ L·mo1-l,若此时再向容器中充入H2、S2、H2S各0.8mol,则平衡移动方向为________(填“正向”、“逆向”或“不移动”);
②温度为T2时T2>Tl),在1L恒容容器中也加入1.8mol H2、1.2mol S2,建立平衡时测得S2的转化:率为25%,据此判断△H1________ 0(填“>”或“<”),与T1时相比,平衡常数K1________(填“增大”、“减小”或“不变”);
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是__________________(写出主要反应的离子方程式),该溶液中,[Na+l ________2[ SO

②在某NaHSO3、Na2SO3混合溶液中HSO


正确答案
解析
解析已在路上飞奔,马上就到!
知识点
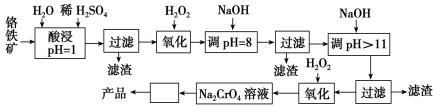
28.以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体的工艺流程如下:
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下。
(1)流程中两次使用了H2O2,分别写出反应的离子方程式:
__________________________________、____________________________。
(2)加入NaOH调节溶液的pH=8时,被除去的离子是________;调节溶液的pH>11时,被除去的离子是________。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤不能省略,为什么?____________。
(4)流程图中“
正确答案
(1) 2Fe2++H2O2+2H+===2Fe3++2H2O
2CrO+3H2O2+2OH-===2CrO+4H2O
(2)Fe3+、Al3+ Mg2+
(3) Al(OH)3会溶解
(4)蒸发浓缩、冷却结晶
解析
解析已在路上飞奔,马上就到!
知识点
4.根据下列操作及现象,所得结论正确的是( )
正确答案
解析
A.NH3?H2O为弱电解质,加水稀释促进电离,由于溶液体积增大,pH反而减小,故A错误;
B.由于硝酸可以将SO32-氧化为SO42-;以及与BaCl2产生白色沉淀的溶液中还可能含有Ag+
所以向某无色溶液中滴加硝酸酸化的BaCl2溶液,产生白色沉淀,原溶液中还可能含有SO32-或者还可能含有Ag+,故B错误;
C.盐类的水解为吸热反应,升高温度促进水解,可根据溶液颜色判断,故C正确;
D.向溴水中加入少量苯,振荡静置后水层为无色是由于苯萃取了溴水中的Br2,故D错误.
考查方向
解题思路
A.加水稀释过程中由于溶液体积增大,pH反而减小;
B.硝酸可以将SO32-氧化为SO42-;
C.盐类的水解为吸热反应,升高温度促进水解,可根据溶液颜色判断,故C正确
D.向溴水中加入少量苯,振荡静置后水层为无色是由于苯萃取了溴水中的Br2
易错点
A.不了解加水稀释过程中由于溶液体积增大,pH反而减小;
B.忽略硝酸可以将SO32-氧化为SO42-;以及与BaCl2产生白色沉淀的溶液中还可能含有Ag+
C.盐类的水解为吸热反应;
D.苯与液Br2在催化剂作用下才可以发生加成反应。
知识点
扫码查看完整答案与解析