- 常见的能量转化形式
- 共45题
1.在298K时,NaCl在水中的溶解度为36g/100g水。如将0.5molNaCl溶解在1L水中,此溶解过程中体系的△H-T△S和熵如何变化( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.下列解释实验现象的离子反应方程式正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.已知I、 II反应在一定条件节焓变及平衡常数如下:
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g)
(2)回答下列反应(I)的相关问题:
①温度为T1,在1L恒容容器中加入1.8mol H2、1.2mol S2, l0min时反应达到平衡。测得l0min内V(H2S)=0.08 mol·L-1·min-l,则该条件下的平衡常数为________ L·mo1-l,若此时再向容器中充入H2、S2、H2S各0.8mol,则平衡移动方向为________(填“正向”、“逆向”或“不移动”);
②温度为T2时T2>Tl),在1L恒容容器中也加入1.8mol H2、1.2mol S2,建立平衡时测得S2的转化:率为25%,据此判断△H1________ 0(填“>”或“<”),与T1时相比,平衡常数K1________(填“增大”、“减小”或“不变”);
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是__________________(写出主要反应的离子方程式),该溶液中,[Na+l ________2[ SO

②在某NaHSO3、Na2SO3混合溶液中HSO


正确答案
解析
解析已在路上飞奔,马上就到!
知识点
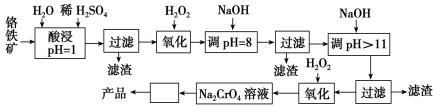
28.以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体的工艺流程如下:
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下。
(1)流程中两次使用了H2O2,分别写出反应的离子方程式:
__________________________________、____________________________。
(2)加入NaOH调节溶液的pH=8时,被除去的离子是________;调节溶液的pH>11时,被除去的离子是________。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤不能省略,为什么?____________。
(4)流程图中“
正确答案
(1) 2Fe2++H2O2+2H+===2Fe3++2H2O
2CrO+3H2O2+2OH-===2CrO+4H2O
(2)Fe3+、Al3+ Mg2+
(3) Al(OH)3会溶解
(4)蒸发浓缩、冷却结晶
解析
解析已在路上飞奔,马上就到!
知识点
4.根据下列操作及现象,所得结论正确的是( )
正确答案
解析
A.NH3?H2O为弱电解质,加水稀释促进电离,由于溶液体积增大,pH反而减小,故A错误;
B.由于硝酸可以将SO32-氧化为SO42-;以及与BaCl2产生白色沉淀的溶液中还可能含有Ag+
所以向某无色溶液中滴加硝酸酸化的BaCl2溶液,产生白色沉淀,原溶液中还可能含有SO32-或者还可能含有Ag+,故B错误;
C.盐类的水解为吸热反应,升高温度促进水解,可根据溶液颜色判断,故C正确;
D.向溴水中加入少量苯,振荡静置后水层为无色是由于苯萃取了溴水中的Br2,故D错误.
考查方向
解题思路
A.加水稀释过程中由于溶液体积增大,pH反而减小;
B.硝酸可以将SO32-氧化为SO42-;
C.盐类的水解为吸热反应,升高温度促进水解,可根据溶液颜色判断,故C正确
D.向溴水中加入少量苯,振荡静置后水层为无色是由于苯萃取了溴水中的Br2
易错点
A.不了解加水稀释过程中由于溶液体积增大,pH反而减小;
B.忽略硝酸可以将SO32-氧化为SO42-;以及与BaCl2产生白色沉淀的溶液中还可能含有Ag+
C.盐类的水解为吸热反应;
D.苯与液Br2在催化剂作用下才可以发生加成反应。
知识点
扫码查看完整答案与解析