- 常见的能量转化形式
- 共45题
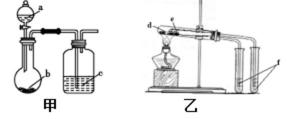
2.下列叙述正确的是( )
①装置甲可防止铁钉生锈 ②装置乙可除去乙烷中混有的乙烯
③装置丙可验证HCl气体在水中的溶解性 ④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体
正确答案
解析
①在装置中,金属Fe做电解池的阳极,电极本身失电子,更易生锈,故①错误;
②高锰酸钾具有氧化性,可以将乙烯氧化为二氧化碳,带入了新的杂质二氧化碳,故②错误;
③氯化氢极易溶于水,挤压胶头滴管,则集气瓶中压强减小,所以气球鼓起来,可以使用该装置验证HCl气体在水中的溶解性,故③正确;
④乙酸乙酯可以用饱和碳酸钠来吸收,不能用氢氧化钠,乙酸乙酯在氢氧化钠中水解,故④错误;
⑤装置可以收集气体,当集气瓶来用,导管长进短出时,可以收集密度大于空气的气体,如:CO2、Cl2、HCl、NO2等气体,如果当洗气瓶,导管应长进短出,故⑤正确。
故选C。
考查方向
解题思路
①金属做电解池的阳极时,更易被腐蚀;
②高锰酸钾具有氧化性,可以将乙烯以及乙炔氧化为二氧化碳;
③氯化氢极易溶于水,根据大气压强原理来分析;
④乙酸乙酯可以用饱和碳酸钠来吸收;
⑤装置可以收集气体,当集气瓶来用,也可以当洗气瓶,但是要注意导管的连接情况。
易错点
本题考查较为综合,涉及化学原电池、物质的制备、性质以及气体收集等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大
知识点
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
Ⅰ.2NO2(g)+NaCl(g)
Ⅱ.2NO(g)+Cl2(g)
请回答下列问题:
13.4NO2(g)+2NaCl(g)
14.若反应Ⅰ在绝热密闭容器中进行,实验测得NO2(g)的转化率随时间变化如图所示,t3~t4时刻NO2(g)的转化率(NO2%)降低的原因是____________。
15.若反因Ⅱ在恒温、恒容条件下进行,下列能判断该反应一定达到平衡状态的是__________。
A.容器内压强不再变化
B.n(ClNO)=n(NO)
C.混合气体密度不变
D.v正(NO)=v逆(ClNO)
16.在一定温度和压强下,反应Ⅱ达到平衡,当NO和Cl2的比例不同时,对Cl2的转化率及平衡混合物中ClNO的体积分数都有影响。设NO和Cl2起始物质的量之比为x,平衡时Cl2的转化率为a,平衡混合物中ClNO的体积分数为y,y=_______。(用a和x的代数式表示y)
17.实验室用NaOH溶液吸收NO2,反应:2NO2+2NaOH=NaNO3+NaNO2+H2O。
含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol/L CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)、c(CH3COO-)由大到小的顺序______。(已知HNO2的电离常数K3=7.1×10-4 mol/L,CH3COOH的电离常数K4=1.7×10-5mol/L)。常温下,向溶液B中加水稀释过程中,下列比值变大的是_______。
a.c(H+)/c(OH-)
b.c(OH-)/c(CH3COO-)
c.c(Na+)/c(CH3COO-)
d.c(CH3COO-)·c(H+)/c(CH3COOH)
正确答案
2ΔH1—ΔH2
K12/K2
解析
①方程式4NO2(g)+2NaCl(g)
②由方程式I得:
由方程式II得:
而所求方程式的平衡常数
考查方向
解题思路
依据化学方程式叠加法、化学平衡原理、水解规律及守恒原理解题。
正确答案
因反应为放热反应且反应容器为绝热容器,随着反应的进行,体系的温度会升高,故再次达平衡时的转化率会降低。
解析
若反应Ⅰ:2NO2(g)+NaCl(g)
考查方向
解题思路
依据化学方程式叠加法、化学平衡原理、水解规律及守恒原理解题。
易错点
转化率降低的解释
正确答案
AD
解析
若反因Ⅱ:2NO(g)+Cl2(g)
故A.容器内压强不再变化——是平衡标志之一;平衡状态定义所得标志有二,其一是正逆反应速率相等,故D.v正(NO)=v逆(ClNO)——是平衡标志之二(且二者的计量数之比刚好是1:1);其二是各成分的浓度保持不变,而不是物质的量相等,
故B.n(ClNO)=n(NO)——不能作为平衡标志;
C.混合气体密度不变 ——因容器体积一定、且气体反应前后质量守恒,故密度是个不变量,不能作为平衡标志。
考查方向
解题思路
依据化学方程式叠加法、化学平衡原理、水解规律及守恒原理解题。
正确答案
y=2a/(x+1-a)
解析
在一定温度和压强下,反应Ⅱ达到平衡,……。设NO和Cl2起始物质的量之比为x,则n(Cl2)=1 mol时,n(NO)=x,若平衡时Cl2的转化率为a,则有:
2NO(g)+Cl2(g)
始量/mol x 1 0
变量/mol 2a a 2a
平量/mol x-2a 1-a 2a
故平衡混合物中ClNO的体积分数为y=2a/[(x-2a)+(1-a)+2a] =2a/(x+1-a)
考查方向
解题思路
依据化学方程式叠加法、化学平衡原理、水解规律及守恒原理解题。
正确答案
c(NO3-)>c(NO2-)>c(CH3COO-) a b c
解析
有反应:2NO2+2NaOH=NaNO3+NaNO2+H2O知,含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液A——即0.1 mol/L NaNO3和0.1 mol/L NaNO2;溶液B为0.1mol/L CH3COONa溶液。
又已知HNO2的电离常数K3=7.1×10-4 mol/L,CH3COOH的电离常数K4=1.7×10-5mol/L。可得:HNO2的酸性强于CH3COOH,则CH3COONa的水解能力强于NaNO2,NaNO3不水解。因此,同浓度的两溶液中c(NO3-)、c(NO2-)、c(CH3COO-)由大到小的顺序是:
c(NO3-)>c(NO2-)>c(CH3COO-)。
常温下,向溶液B中——即CH3COONa溶液加水稀释过程中,水解程度增大,溶液中n(CH3COO-)减少、c(CH3COO-)也减少;n(CH3COOH)增大、但因水量增大而使c(CH3COOH)降低;n(OH-)增大、但也因水量增大而c(OH-)降低,此时相反的是c(H+)则增大。故:
a.c(H+)/c(OH-) 比值变大;
b.c(OH-)/c(CH3COO-)= n(OH-)/ n(CH3COO-),比值也变大;
c.c(Na+)/c(CH3COO-)= n(Na+)/n(CH3COO-),比值也变大;
d.c(CH3COO-)·c(H+)/c(CH3COOH)= K4=1.7×10-5mol/L,不变。
考查方向
解题思路
依据化学方程式叠加法、化学平衡原理、水解规律及守恒原理解题。
易错点
两溶液中离子浓度大小比较
将猫薄荷中分离出的荆芥内酯与等物质的量的氢气进行加成,得到的二氢荆芥内酯是
一种有效的驱虫剂,可用于商业生产。下图为二氢荆芥内酯的一种合成路线:
已知:A(C10H16O)的结构中有一个五元环,能发生银镜反应。回答下列问题:
20.由D生成二氢荆芥内酯的化学方程式为 _______________________ 。
21.D在某催化剂作用下可发生反应生成一种高聚物,其结构简式为 ______ ,
22.写出符合以下条件的荆芥内酯的同分异构体的结构简式_______________ ,
①结构中含有苯环 ②只有一个侧链 ③能发生酯化反应 ④不能发生消去反应
其分子中最多有 个碳原子在同一平面上。
23. 已知:同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮。完成下列合成
内酯路线:
正确答案

解析
A的分子式为C10H16O,不饱和度为






由D生成二氢荆芥内酯的化学方程式为:

考查方向
解题思路
A的分子式为C10H16O,不饱和度为 







易错点
有机物的推断与合成线的设计、已知信息的应用、官能团的性质和反应类型。
正确答案
解析
A的分子式为C10H16O,不饱和度为






D再浓硫酸条件下缩聚反应得到高聚物E为
考查方向
解题思路
A的分子式为C10H16O,不饱和度为 







易错点
有机物的推断与合成线的设计、已知信息的应用、官能团的性质和反应类型。
正确答案

解析
A的分子式为C10H16O,不饱和度为






符合以下条件的二氢荆芥内酯的同分异构体:①结构中含有苯环,则侧链没有不饱和键; ②只有一个侧链,③能发生酯化反应,含有羟基,④不能发生消去反应,该同分异构体结构简式为:

考查方向
解题思路
A的分子式为C10H16O,不饱和度为 







易错点
有机物的推断与合成线的设计、已知信息的应用、官能团的性质和反应类型。
正确答案
解析
A的分子式为C10H16O,不饱和度为






已知:同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮。完成下列合成内酯
据官能团的性质,对二甲苯




故答案为:
考查方向
解题思路
A的分子式为C10H16O,不饱和度为 







易错点
有机物的推断与合成线的设计、已知信息的应用、官能团的性质和反应类型。
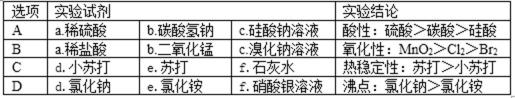
6.用下图所示装置进行实验,能得出相应实验结论的是( )
甲 乙
正确答案
解析
:A..强酸能弱酸盐反应生成弱酸,根据强酸制取弱酸判断酸性强弱,稀硫酸和碳酸氢钠反应生成二氧化碳,二氧化碳、水和硅酸钠反应生成难溶性硅酸,看到的现象是烧瓶中有气体生成、c中有沉淀生成,所以可以实现实验目的,故A正确;B.稀盐酸和二氧化锰不反应,浓盐酸和二氧化锰在加热条件下反应生成氯气,所以不能得到氯气,不能实现实验目的,故B错误;C.碳酸钠热稳定性较强,碳酸氢钠不稳定,受热易分解,所以d为碳酸钠、e为碳酸氢钠,故C错误;D.氯化铵不稳定受热易分解,所以该装置不能实现实验目的,故D错误;
考查方向
解题思路
A.强酸能弱酸盐反应生成弱酸,根据强酸制取弱酸判断酸性强弱;
B.稀盐酸和二氧化锰不反应,浓盐酸和二氧化锰在加热条件下反应生成氯气;
C.碳酸钠热稳定性较强,碳酸氢钠不稳定,受热易分解;
D.氯化铵不稳定受热易分解.
易错点
对反应装置即实验过程和实验结论认识不清
知识点
7.加热HCOONa固体,发生的反应有( )
HCOONa加热分解时,固体失重率与温度的关系如下图所示。下列说法正确的是( )
正确答案
解析
A.加热完全分解得到Na2C2O4时,失重率为2/136×100%≈1.47%<5%,则T<415℃时反应①、②同时发生,故B错误;B.由A中分析可知,反应①、②可能同时发生,故B错误;C.加热分解完全残留固体为Na2CO3,失重率为30/136×100%≈22.1%,则570℃<T<600℃时,残留固体的主要成分是Na2CO3,故C正确;D.残留固体中的m(Na2C2O4)=m(Na2CO3)时,无法判断所需时间,不能判断反应①、②的反应速率,故D错误.
考查方向
解题思路
加热分解完全残留固体为Na2CO3,失重率为30/136×100%≈22.1%,则570℃<T时残留固体的主要成分是Na2CO3,完全分解得到Na2C2O4时,失重率为2/136×100%≈1.47%,则T<415℃时反应①、②同时发生,残留固体中的m(Na2C2O4)=m(Na2CO3)时,无法判断所需时间,不能判断反应①、②的反应速率.
易错点
对图像的分析不到位
知识点
扫码查看完整答案与解析