- 铁的化学性质
- 共19题
由5mol Fe2O3、4mol Fe3O4和3mol FeO组成的混合物中,加入纯铁lmol并在高温下和 Fe2O3反应。若纯铁完全反应,则反应后混合物中FeO与Fe2O3的物质的量之比可能是
正确答案
解析
略
知识点
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3=== FeCO3↓+Na2SO4 FeCO3+C6H8O7 === FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是 。
a.将FeSO4溶液与Na2CO3 溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是 。
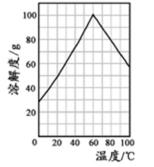
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,先制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, ,得到FeSO4 溶液, ,得到FeSO4·7H2O 晶体。
正确答案
见解析。
解析
(1)c 避免生成Fe(OH)2沉淀
(2)取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。
(3)①防止+2价的铁元素被氧化 ②加入适量柠檬酸让铁粉反应完全
(4)降低柠檬酸亚铁在水中的溶解量,有利于晶体析出
(5)“(过滤,)向反应液中加入足量的铁粉,充分搅拌后,滴加NaOH溶液调节反应液的pH约为5,过滤”或“过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤”
(滴加稀硫酸酸化,)加热浓缩得到60℃饱和溶液,冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥
知识点
下列有关实验操作、现象和解释或结论都正确的是
正确答案
解析
本题综合考查化学实验以及元素化合物的相关知识。
A选项,铁粉过量应该生成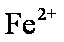
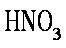
知识点
为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。已知:
请回答:(1)稀硝酸和Cu反应的化学方程式为_________。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、硝酸钠溶液、稀盐酸。
方案:_________。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
①据实验现象写出发生反应的离子方程式:_________。
②导致实验过程中溶液pH略有上升的可能原因是_________。
③解释乙同学的实验现象
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:_________。
正确答案
见解析。
解析
(1)3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
(2)测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应。
(3)①Cu + 2Fe3+ = Cu2+ + 2Fe2+
②Fe3+ 变为Cu2+和Fe2+,水解能力下降
③在此酸性条件下NO3-不能氧化Cu。
(4)将铜片放入0.5mol/L氯化铁溶液中
知识点
29.铁不能与冷水反应,但能与水蒸气反应,某化学兴趣小组为探究铁与水蒸气反应,请你为他们完成实验报告。
实验目的:探究铁与水蒸气的反应
反应原理:( )(用化学反应方程式表示)
实验装置:回答以下问题(加热装置略去)
实验装置改进:兴趣小组同学根据反应原理改进实验装置,

问:试管底部是蘸有水的湿棉花,其作用是( ),
蒸发皿内加入的肥皂液的作用( ) 。
正确答案
实验装置改进:用来产生水蒸气; 证明生成的气体是氢气并验纯。
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析