- 铁的氧化物和氢氧化物
- 共28题
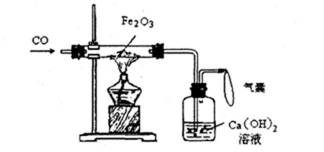
某化学小组利用下图装置完成Fe2O3和CO的反应。
(1)实验开始前,首先必须进行的操作为_______。实验开始时,通入CO气体和加热的先后顺序为_______,点燃酒精灯之前,必须检验装置中排出的CO的纯度。实验过程中,判断反应发生的现象为_______。
(2)实验时可在酒精灯火焰上罩一个金属网罩,该金属网罩的作用是_______。酒精灯对Fe2O3加热温度可达500~600°C,若要提高反应温度,还可选用的加热仪器为_______。
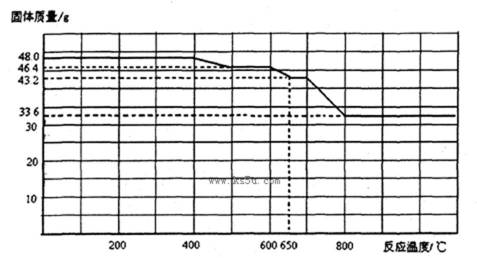
(3)查阅资料知,Fe2O3和CO进行加热反应,固体质量与反应温度的关系如下图所示。
则500~600°C时Fe2O3的还原产物是_______。请设计一个简单实验,证明650~700°C时Fe2O3的还原产物,简述实验操作和现象_______。(可供选择的试剂:稀硫酸、稀盐酸、KMnO4溶液、NaOH溶液、KSCN溶液)
正确答案
(1)检查装置的气密性;先通入CO一段时间,后加热;红棕色粉末逐渐变黑,澄清石灰水变浑浊
(2)提高反应温度,确保受热均匀;酒精喷灯
(3)Fe3O4 ;在适量待检物中加入稀硫酸至完全溶解,再加入少量高锰酸钾溶液,溶液紫色褪去(其他合理答案也给分)
解析
(1)一般来说,凡涉及气体,特别是有毒气体的组装实验装置,实验前都需要检验装置气密性,而对含可燃气体的装置加热时,要确保加热时可燃气体中不含有空气,以防爆炸。
(2)金属网罩可以使火力更加集中,提高加热温度。
(3)CO还原Fe2O3的还原产物可能为Fe3O4,FeO和Fe,根据图中质量变化可知500℃——600℃的还原产物为Fe3O4,650℃——700℃的还原产物为FeO,而800℃以后的还原产物为Fe。要检验FeO,可以利用Fe2+不能与KSCN显色,而被氧化后可与KSCN显色的性质,也可以利用Fe2+能使KmnO4溶液褪色的性质。
知识点
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多是
正确答案
解析
略
知识点
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和

(1)
(2)

(3)配平用钙线氧脱鳞的化学方程式:
P+ FeO+ CaO

(4)将钙线试样溶于稀盐酸后,加入过量


(5)取1.6g钙线试样,与水充分反映,生成224ml.


正确答案
(1)第四周期第ⅡA族,
(2) 
(3)2P+5FeO+3CaO
(4)Fe;Fe+3SCN-=Fe(SCN)3
(5)1.1
解析
本题考查钙、铁的知识。
(1)Ca为20号,位于第四周期,第IIA族。
(2)最活泼的金属为:F, 







(5)








知识点
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和漓定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol/L的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中,x值:———(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(C1)=1:2.1,则该洋品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和__________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________________,该电池总反应的离子方程式为________________。
正确答案
(1)n(Cl)=0.0250L×0.40 mol∙
(2)10% 盐酸 氯气
(3)
(4)
解析
此题为中档题,前3问这里面就不说了,在计算第一问X值的时候,完全可以把x=2或者x=3代入,这样可以节损时间。第四问也是近几年多次考到的高铁酸钾,有关高铁酸钾的制备与电化学,第四小问考查化学基本功,这里面有很好的区分度,扎实的同学拿满分没问题。第一个方程式多次书写过,第二个方程式,很多同学觉得无法书写,其实首先写大体物质,高铁酸根被还原为Fe3+,然后再写出转移的电子数,根据电荷守衡,因为溶液是碱性的,所以产物只能写成8个OH-,一个Fe3+结合3个OH-生成Fe(OH)3,因为负极反应式为Zn-2e-=Zn2+最后一个方程式只需要综合得失电子守衡就可以得出正确答案。
知识点
高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是
正确答案
解析
高铁酸钾中的铁元素显+6价,具有强氧化性,可消毒杀菌,被还原后生成的+3价的铁离子可发生水解生成氢氧化铁胶体,从而可吸附水中的杂质。
知识点
扫码查看完整答案与解析