- 亚铁离子和三价铁离子的检验
- 共16题
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用第试剂KSCN溶液、K3[Fe(CN)6]溶液、氯水。
请完成下表:
【实验结论】Fe的氧化产物为存在Fe2+和Fe3+
Ⅱ. AgNO3的热稳定性性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
(1)装置B的作用是 。
(2)经小组讨论并验证该无色气体为O2,其验证方法是 。
(3)【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:ⅰAg;ⅱ.Ag2O;ⅲ.Ag和Ag2O
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
【实验评价】根据上述实验,不能确定固体产物成分的实验是 ① (填实验编号)。
【实验结论】根据上述实验结果,该小组得出的AgNO3固体热分解的产物有 ② 。
正确答案
见解析。
解析
(1)Fe3+ 与SCN-络合形成血红色溶液
Fe2+ 与CN-络合形成普鲁士蓝溶液
(2)防止溶液倒吸进试管
(3)用带火星木条靠近瓶口,木条复燃,证明是氧气
(4)①b实验中,黑色固体溶解,可能有Ag或者Ag2O 有气体产生证明有Ag ,所以不能证明确定有Ag2O ②红棕色气体是NO2 实验证明有Ag O2
知识点
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理。记录如下(a.b.c代表电压数值):
(1)用KSCN检验出Fe3+的现象是_______________________。
(2)I中,Fe3+产生的原因可能是Cl—在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应:
____________________________________________________。
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有_________性。
(4)II中虽未检验出Cl2,但Cl—在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
①NaCl的浓度是_________mol/L
②IV中检测Cl2的实验方法______________________________________________。
③与II对比,得出的结论(写出两点):_____________________________________________。
正确答案
答案:(1)溶液变红
(2)2Cl— -2e— =Cl2↑ Cl2+2Fe2+=2Fe3++2Cl—
(3)还原
(4)①0.2 ②湿润的淀粉碘化钾试纸变蓝 ③加大电压cV以上时可以生成Cl2;阳极放电顺序Fe2+>Cl—
解析
略
知识点
下列依据相关实验得出的结论正确的是
正确答案
解析
略
知识点
下列有关实验原理、方法和结论都正确的是
正确答案
解析
本题属于常规实验与基本实验考查范畴。A:饱和FeCl3溶液逐滴滴入沸水中,并不断搅拌,可制取Fe(OH)3胶体。滴加过量氨水,就会产生Fe(OH)3沉淀。B:溶液X中应先滴KSCN溶液,不呈红色,再滴入适量新制氨水,溶液变红,才能说明X溶液中一定含有Fe2+。C:苯酚与NaOH溶液反应可生成水溶性的苯酚钠,可与苯分层,实现分离除杂。D:溶解平衡I3-

知识点
11.下列由实验现象得出的结论正确的是:( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
下列陈述II正确并且有因果关系的是
正确答案
解析
A关系不对,陈述Ⅱ是还原性。B二氧化硅不导电。C关系不对,陈述Ⅱ是吸水性
知识点
离子液体是一种室温熔融盐,为非水体系,由有机阳离子.Al2Cl7—和AlCl4—组成的
(1)钢制品应接电源的_______极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_______。若改用AlCl3水溶液作电解液,则阴极产物为_______。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为_______mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有_______。
a. KCl
b. KClO3
c. MnO2
d. Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,_______(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是_______(用离子方程式说明)。
正确答案
(1)负极;
(2)3
(3)b、d;不能;Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+
解析
略。
知识点
对实验Ⅰ~Ⅳ的实验现象预测正确的是
正确答案
解析
略
知识点
已知:Fe5O7可以看作Fe2O3和Fe3O4的混合物。现有Fe、Fe2O3、Fe5O7混合物共0.1 mol,加盐酸后固体全部溶解,共收集到0.01 mol H2,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为
正确答案
解析
略
知识点
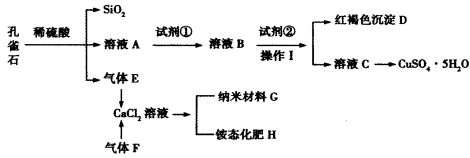
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O及纳米材料G,主要步骤如下:
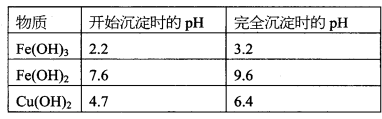
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+沉淀完全。Fe3+、Fe2+、
Cu2+开始沉淀及完全沉淀的pH分别如下:
请回答下列问题:
(1)孔雀石主要成分Cu2(OH)2CO3与稀硫酸反应的化学方程式为_______________。
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。要检验其中的Fe2+应选择下列试剂中的___________(填序号)。
a。KMnO4 b。NaOH C。H2O2 d。KSCN
(3)试剂①是一种氧化剂,加入该氧化剂的作用是______________;
(4)向溶液B中加入试剂②的化学式为__________________。
(5)气体E和气体F应该先通入CaCl2溶液中的是_______________(填化学式)。写出制备G和H的化学反应方程式______________。
(6)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中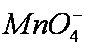
mol/L KMnO4溶液16。00 mL时,恰好达到滴定终点,则A溶液中Fe2+浓度为________。
正确答案
(1)Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑
(2)a
(3)将溶液中的Fe2+氧化为Fe3+(以便在Cu(OH)2沉淀之前,通过调节溶液pH使Fe(OH)3沉淀完全)
(4)CuO或Cu(OH)2或CaCO3 或Cu2(OH)2CO3 (写一种即可,多写且正确不扣分)
(5)NH3 2NH3+CO2+CaCl2+H2O==CaCO3↓+2NH4Cl
(6)MnO4- + 5Fe2+ + 8H+=== Mn2+ + 5Fe3+ + 4H2O 0.0960mol/L
解析
略。
知识点
扫码查看完整答案与解析