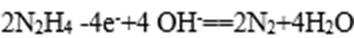- 热化学方程式
- 共127题
化合物


(1)已知




(2)反应


①列式计算实验a从反应开始至达到平衡时的反应速率 v(
②图中3组实验从反应开始至达到平衡时的反应速率v(
③用

正确答案
(1)
(2)①
②bca;加入催化剂。反应速率加快,但平衡点没有改变;温度升高。反应速率加快,但平衡点向逆反应方向移动(或反应容器的溶剂和起始物质的量未改变,但起始总压强增大)
③
解析
略。
知识点
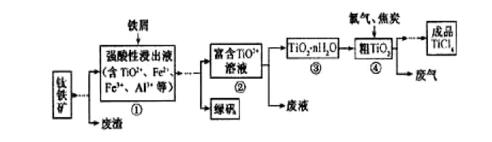
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。
2Fe3++Fe=3Fe2+
2TiO2+(无色) +Fe+4H+=2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O=TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在_______范围。
(3)若把③中制得的固体TiO2·n H2O用酸清洗除去其中的Fe (OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe (OH)3+3H+
(4)已知:TiO2 (s) +2 Cl2 (g)=TiCl4(l) +O2(g) △H=+140KJ·mol-1
2C(s) +O2(g)=2CO(g) △H=-221KJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:_____________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________(只要求写出一项)。
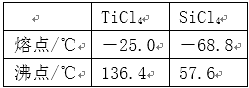
(6)依据右表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
正确答案
见解析。
解析
(1)根据题意给出方程式分析铁屑的作用就是作为还原剂的,即:将Fe3+还原为Fe2+,另外浸出液显紫色,说明含有Ti3+,防止Ti3+被Fe3+氧化成TiO2+。参考答案中“生成Ti3+保护Fe2+不被氧化。”有点让人费解,能不能说成“防止Ti3+被Fe3+氧化成TiO2+”或者说“将TiO2+还原成Ti3+”。
(2)形成TiO2·n H2O溶胶,说明得到胶体,其分散质颗粒直径大小为10-9~10- 7m(或1nm—100nm);
(3)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH—)=2.79×10—39,25℃时,c(H+)×c(OH—)=Kw=1×10—14;反应Fe (OH)3+3H+
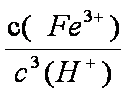
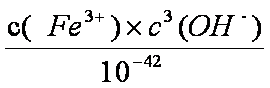

(4)涉及盖斯定律计算,比较常规,按要求写出方程式相加即可得出答案:
TiO2(s)+ 2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g) △H=—81KJ·mol-1
(5)依据绿色化学理念,该工艺流程中存在的不足之处产生了废气,废液,废渣等。
(6)右表信息可以看出,SiCl4,TiCl4两者的沸点相差较大,要精制含少量SiCl4杂质的TiCl4可用蒸馏(或分馏)等方法。
知识点
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
正确答案
解析
略
知识点
下表列出了3种燃煤烟气脱硫方法的原理。
(1) 方法Ⅰ中氨水吸收燃煤烟气中
能提高燃煤烟气中
a增大氨水浓度 b升高反应温度
c使燃煤烟气与氨水充分接触 d通入空气使
采用方法Ⅰ脱硫,并不需要先出去燃煤烟气中大量的
(2) 方法Ⅱ重要发生了下列反应:







(3) 方法Ⅲ中用惰性电极电解
正确答案
(1)a c HCO3- +SO2= CO2+HSO3-
(2)S(g)+O2(g) = SO2 (g) ⊿H=-574.0kJ·mol-1
(3)O2、 SO2
解析
略
知识点
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2H4 (1) △H1= -19.5kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2H4 反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
正确答案
(1)5
(2)2NH3+NaClO==N2H4+NaCl+H2O
(3)2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H2= -1048.9kJ·mol-1
(4)
解析
(1)N原子的原子结构示意图为: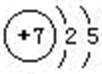
(2)NH3+NaClO——N2H4,根据元素守恒还应生成NaCl和H2O,观察法可配平方程式为 2NH3+NaClO==N2H4+NaCl+H2O;
(3)肼与N2O4反应生成N2和水蒸气:2N2H4 +N2O4==3N2+4H2O,观察已知的两个热方程式可知,②×2-①得:2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H2= -1048.9kJ·mol-1
(4)“肼一空气燃料电池是一种碱性电池”中O2在正极反应,故负极是肼发生反应:
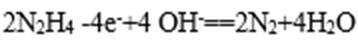
知识点
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量CO2)直接制备二甲醚,其中主要过程包括下列四个反应:
甲醇合成反应:
(i)CO(g)+2H2(g)=CH3OH(g) △H1=-90.1 kJ/mol
(ii)CO2(g)+3H2(g)=CH3OH(g)+H2O △H2=-40.9 kJ/mol
水煤气变换反应:
(iii)CO(g)+H2O(g)= CO2(g)+H2(g) △H3=-41.1 kJ/mol
二甲醚合成反应:
(iv)2CH3OH(g)= CH3OCH3(g)+H2O △H4=-24.5 kJ/mol
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂主要成分之一。工业上从铝土矿制备高纯Al2O的主要工艺流程是 。(用化学方程式表示)
(2)分析二甲醚合成反应(iv)对CO转化率的影响 。
(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。根据化学反应原理,增加压强对直接制备二甲醚的反应的影响 。
(4)有研究者在催化剂(含Cu-Zn-Al-O、Al2O3)、压强在5.0Mpa条件下,由H2和CO直接制备二甲醚,结果如图所示。其中CO转化率随温度升高而降低的原因是 。
(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为 。一个二甲醚分子经过电化学氧化,可以产生 个电子的电量:该电池理论输出电压为1.20V,能量密度E= (列式计算,能量密度=电池输出电能/燃料质量)。
正确答案
(1)Al2O3+2NaOH+3H2O=2NaAl(OH)4
NaAl(OH)4+CO2=Al(OH)3+NaHCO3、2 Al(OH)3
(2)消耗甲醇,促进甲醇合成反应(i)平衡向右移,CO转化率增大:生成的水通过水煤气变换反应(iii)消耗部分CO。
(3)2CO(g)+4H2(g)=CH3OCH3(g)+H2O △H=-204.7 kJ/mol;该反应分子数减小,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加,压强升高使CO和H2浓度增大,反应速率加快。
(4)反应放热,温度升高,平衡左移。
(5)CH3OCH3+3H2O=2CO2+12H++12e-;12;
解析
略
知识点
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时:
①HF(aq) + OH—(aq) == F—(aq) + H2O(l) △H = - 67.7 kJ•mol-1
②H+ (aq) + OH—(aq) == H2O(l) △H = - 57.3 kJ•mol-1
在20 mL 0. 1 mol•L-1氢氟酸中加入V mL 0. 1 mol•L-1NaOH溶液。下列有关说法正确的是
正确答案
解析
本题考查盖斯定律的应用、酸碱中和反应及溶液中离子浓度大小的比较,旨在考查考生对所学生所学知识的整合及应用能力。。
根据盖斯定律,将①式减去②式经整理可得:
HF(aq) 
由反应①放热比反应②多,亦可判断氢氟酸的电离为放热,本题要求突破“弱电解质电离都是吸热”的思维定势。故A选项错误。
当V=20时,两者恰好完全反应生成NaF,溶液中存在质子守恒关系:
c(OH-) = c(HF)+c(H+)
质子守恒式有两种方法推得:
(1)直接推得:因F-水解结合H2O电离出的H+生成HF并提供与HF等量的OH—,且H2O本身电离出H+和OH—;
(2)由NaF溶液的电荷守恒式和物料守恒式求得:NaF溶液的电荷守恒式:
c(Na+) + c(H+) = c(F-) + c(OH-)
NaF溶液的物料守恒式:c(Na+) = c(HF) + c(F-)
消去2个式子中的c(Na+)可得出其质子守恒式 。
因F-水解,故溶液中存在:c(F-)<c(Na+) = 0.05 mol•L-1 ,故B选项正确,C选项错误。
D选项:溶液中离子浓度的大小取决于V的大小,离子浓度大小关系可能为c(F-)>c(H+)>c(Na+)>c(OH-)或c(F-)>c(Na+)>c(H+)>c(OH-)或c(Na+) = c(F-)>c(OH-) = c(H+)或c(Na+)>c(F-)>c(OH-)>c(H+),故D选项错误。
为了更清晰明确D选项的问题,不妨进行如下分析:
影响溶液中各离子浓度的因素有2个:(1)离子的物质的量;(2)溶液的体积。
根据这2个因素的影响,可绘制出下图:
根据上图,并结合离子的变化,可以得到下表离子浓度的大小比较:
知识点
W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。
(1)X位于元素周期表中第______周期第______族;
(2)X的单质和Y的单质相比,熔点较高的是______(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是______(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是______。
(4)在25°C、101kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190.0kJ,该反应的热化学方程式是______。
正确答案
(1)3;IA;2
(2)Si;HCl
(3)SiCl4+3H2O =H2SiO3↓+3HCl
(4)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-760kJ/mol
解析
本题综合考查元素周期表、晶体结构、元素化合物知识以及热化学方程式等知识。
根据题意,不难推出W为氧,X为钠,Y为硅,Z为氯。
知识点
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: 33CH4(g)+H2O(g)=CO(g)+3H2(g) △H=206.2kJ·mol-1
33CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) △H=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_________。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是_________。燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:_________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图11所示。图中A、B表示的物质依次是_________。
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图12(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为_________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为_________。
正确答案
(1)CH4(g)+2H2O(g) =CO2(g) +4H2(g) △H=165.0 kJ·mol-1
(2)为H2S热分解反应提供热量;2H2S+SO2 =2H2O+3S (或4H2S+2SO2=4H2O+3S2)
(3)H、O(或氢原子、氧原子)
(4)CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
(5)2Mg2Cu+3H2
解析
略。
知识点
已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1,2C(s)+O2(g)=2CO(g),ΔH=-220kJ·mol-1,H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为( )
正确答案
解析
略
知识点
扫码查看完整答案与解析