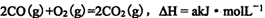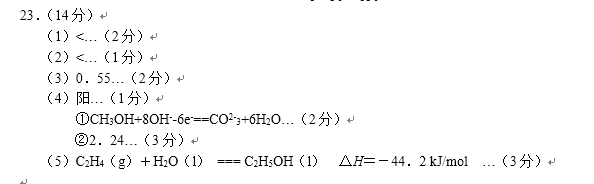- 热化学方程式
- 共127题
15. 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
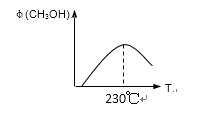
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为
v(CH3OH)=nA/tA mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应

达到平衡时增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反应式为________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1KJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次 增大,其中B与C为同一周期,D与F为同一周期,A与D、C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,另外三种是固体。
请回答下列问题:
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为 ______,其分子属于________(选填“极性”或“非极性”)分子。
D与C形成的化合物D2C2可与Y反应生成单质C,写出该反应的化学方程式并标明电子转移的方向和数目:_______________ 。
(2)E是非金属元素,其单质在电子工业中有重要应用,请写出工业生产单质E的化 学反应方程式: ___________________ 。
(3)一定条件下,A的单质气体与B的单质气体充分反应生成6.8 g W气体(已知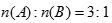
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通人A的单质气体,N极通入C的单质气体,则M极的电极反应式为 __________ 。
(5)在10 L的密闭容器中,通入2 mol的FC2气体和3 mol的C气体单质,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21 mol/L,则平衡时FC2的转化率为______________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23. I.黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
(1)上述反应中,原子半径最小的元素其原子结构示意图为____;
(2)上述反应中,每生成Imol氧化产物转移电子的物质的量为( )mol;
(3)收集黑吠药爆炸后的烟尘和气体产物,分别与酸性高锰酸钾溶液反应,均能使溶液紫红色退去。
①烟尘中能使酸性高锰酸钾溶液退色的物质的化学式是( )。
②气体产物与酸性高锰酸钾溶液反应的离子方程式( ),
II.汽车尾气中含有NO和CO等有害气体。选择适当的催化剂可将CO、NO转化为无毒气体。
(4)已知:
写出NO转化为无毒气体的热化学反应方程式____;
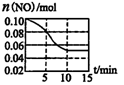
反应过程中NO气体的物质的量与时间的关系如图所示。
①0~5minNO的平均反应速率
②平衡时测得绝热容器内的压强比反应前增大,关于该反应
的说法正确的是____(填选项)
A.是气体分子数增多的反应
B.升高温度平衡常数减小
C.反应物的总能量小于生成物的总能量
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
(1)利用甲烷催化还原氮氧化物。已知:
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:
为提高氮氧化物的转化率可采取的措施是( )(写出1条即可)。
(3)利用ClO2 氧化氮氧化物。其转化流程如下:
已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O= NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ( );若生成11.2 L N2(标准状况),则消耗ClO2( ) g。
(4)利用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)⇌N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应的平衡常数K=( )0.56(保留两位小数).
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是( )减小CO2的浓度
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H ()0(填“>”、“=”或“<”).
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.下表所列是元素周期表部分短周期的主族元素
已知R为地壳中含量最多的金属元素。
(1)写出Z的原子结构示意图________。
(2)W与氢原子形成6原子分子的结构简式_______。
(3)超细RX粉末被应用于大规模集成电路领域。其制作原理为R2Y3.X2.W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1;其反应的化学方程式为_______。
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是_______。
(5)火箭发动机的燃料胼(N2H4)与氧化剂N204反应生成N2和水蒸气。

写出肼和N2O4反应的热化学方程式______________。
(6)温度为T时,向2.0 L恒容密闭容器中充入1.00 mol PCl5,反应

相同温度下,起始时向容器中充入1.00 mol PC15.0.20 mol PCl3和0.40 mol Cl2,反应达到平衡前v(正) _______v(逆)(填“>”或“=”或“<”);原因是_______。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.2008年北京奥运会所用火炬燃料为丙烷,悉尼奥运会所用火炬燃料为65%丁烷和35%丙烷。已知丙烷的燃烧热为:2221.5kJ·mol-1,正丁烷的燃烧热为:2878kJ·mol-1,异丁烷的燃烧热为:2869.6kJ·mol-1。下列有关说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.二氧化碳作为含碳化合物燃烧的最终产物,其排放量正以每年4%的速度递增,大气中高浓度的CO2破坏了大气平衡,是造成全球气温升高、气候恶化的主要原因。随着科技进步和人类环保意识的增强,如何利用和固定CO2已经成为世界各国政府和有识之士特别关注的问题。
根据反应:
某化学兴趣小组设想利用甲烷和二氧化碳反应制取一氧化碳和氢气,实现废气利用,变废为宝,试回答下列问题:
(1)写出该反应的热化学方程式 _________ 。
(2)已知:①体系自由能变化△G<0时,反应自发进行;△G>0时,反应不自发进行;②△G=△H-T△S;③高温下该反应的△S=0.257kJ·mol-1·K-1.若不考虑条件变化对焓变、熵变的影响,据此可初步判断反应进行的最低温度应大于_____________ K。
(3)该反应为可逆反应,其平衡常数表达式K=_________;为提高该反应的速度,需选择合适的催化剂,根据中学化学催化剂的实际应用经验,兴趣小组将选择的重点范围确定为________(填“主族”或“过渡”)元素的单质或氧化物。由于该反应需在较高温度下才能发生,对催化剂的选择探究增加了困难。某同学认为,该反应的逆反应在常温时能自发进行(△G<0),可在常温下对逆反应进行催化剂的选择探究,然后再对该催化剂的催化效率受温度的影响进行探究。一种对逆反应有效的催化剂,对正反应也一定有效,其理由是 _____________ 。
(4)碳酸盐是人工固定二氧化碳仅次于尿素的第二大产品,用途广泛,一种熔融碳酸盐燃料电池用Li2CO3和K2CO3的熔融盐混合物作电解质,由外部向一电极供给燃料气体(如H2或CO等),向另一电极供给空气和CO2的混合气体,写出正极的电极反应式__________ 。
(5)自然界固定二氧化碳的主要方式是绿色植物的光合作用。生物学家曾经认为地球上的生态系统离不开阳光,但在11000m漆黑的深海底发现了无脊椎动物。这些生物完全依靠化学自养菌,以海底热泉喷出液中的硫化物如H2S为能源,利用CO2合成(C6H10O3)n和一种淡黄色固体,写出该反应的化学方程式 ____________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.甲、乙、丙、丁四种物质转化关系如右图。已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素。
(1)若乙是难溶于水的酸性氧化物。
①乙的一种重要用途是( );
②丙溶液中通入少量CO2生成丁的离子方程式是 ( )。
(2)若2乙(g) + 甲(g) 
恒容条件下,一定量的乙和甲发生反应,不同温度下乙的转化率如下表所示:
①该反应的△H 0(填“>”、“<”或“=”,下同);
②若400℃和500℃的化学平衡常数分别为K1、K2,则K1( ) K2。
(3)若丙是离子化合物,且阴离子含金属元素R。
①R的原子结构示意图是( ) ;
②已知:R(s) + 

Mn(s) + O2(g) = MnO2(s) △H=-520.9 kJ·mol -1
写出R的单质与MnO2反应的热化学方程式( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
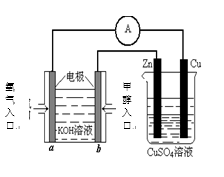
23.能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g)
(2)若在230℃时,平衡常数K=1。若其它条件不变,
将温度升高到500℃时,达到平衡时,K ( ) 1 。
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的( )倍。
(4)利用甲醇燃料电池设计如右图所示的装置:
则该装置中Cu极为( )极;
①写出b极的电极反应式
②当铜片的质量变化为12.8 g时,a极上消耗的 O2
在标准状况下的体积为( ) L。
(5)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l) == C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l) == C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.已知A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol丁分子中不同原子的数目比为1:2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件已略去)。
请回答:
(1)戊与强碱反应的离子方程式:( )。
(2)NaClO的电子式为( )。
(3)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:( ) 。
(4)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知,该反应生成1mol乙时放出536 kJ热量,其热化学方程式为:( )。
(5) 室温下,0.1mol•L-1氯化铵溶液pH=5.1。若室温下氨水的电离常数Kb=10-x,则x=( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析