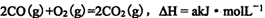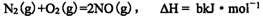- 热化学方程式
- 共127题
23. I.黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
(1)上述反应中,原子半径最小的元素其原子结构示意图为____;
(2)上述反应中,每生成Imol氧化产物转移电子的物质的量为( )mol;
(3)收集黑吠药爆炸后的烟尘和气体产物,分别与酸性高锰酸钾溶液反应,均能使溶液紫红色退去。
①烟尘中能使酸性高锰酸钾溶液退色的物质的化学式是( )。
②气体产物与酸性高锰酸钾溶液反应的离子方程式( ),
II.汽车尾气中含有NO和CO等有害气体。选择适当的催化剂可将CO、NO转化为无毒气体。
(4)已知:
写出NO转化为无毒气体的热化学反应方程式____;
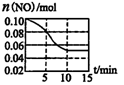
反应过程中NO气体的物质的量与时间的关系如图所示。
①0~5minNO的平均反应速率
②平衡时测得绝热容器内的压强比反应前增大,关于该反应
的说法正确的是____(填选项)
A.是气体分子数增多的反应
B.升高温度平衡常数减小
C.反应物的总能量小于生成物的总能量
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
(1)利用甲烷催化还原氮氧化物。已知:
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:
为提高氮氧化物的转化率可采取的措施是( )(写出1条即可)。
(3)利用ClO2 氧化氮氧化物。其转化流程如下:
已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O= NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ( );若生成11.2 L N2(标准状况),则消耗ClO2( ) g。
(4)利用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)⇌N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应的平衡常数K=( )0.56(保留两位小数).
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是( )减小CO2的浓度
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H ()0(填“>”、“=”或“<”).
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.下表所列是元素周期表部分短周期的主族元素
已知R为地壳中含量最多的金属元素。
(1)写出Z的原子结构示意图________。
(2)W与氢原子形成6原子分子的结构简式_______。
(3)超细RX粉末被应用于大规模集成电路领域。其制作原理为R2Y3.X2.W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1;其反应的化学方程式为_______。
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是_______。
(5)火箭发动机的燃料胼(N2H4)与氧化剂N204反应生成N2和水蒸气。

写出肼和N2O4反应的热化学方程式______________。
(6)温度为T时,向2.0 L恒容密闭容器中充入1.00 mol PCl5,反应

相同温度下,起始时向容器中充入1.00 mol PC15.0.20 mol PCl3和0.40 mol Cl2,反应达到平衡前v(正) _______v(逆)(填“>”或“=”或“<”);原因是_______。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
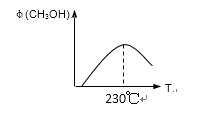
(1)合成甲醇的反应为:CO(g)+2H2(g)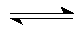
(2)若在230℃时,平衡常数K=1。若其它条件不变,
将温度升高到500℃时,达到平衡时,K ( ) 1 。
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的( )倍。
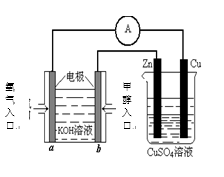
(4)利用甲醇燃料电池设计如右图所示的装置:
则该装置中Cu极为( )极;
①写出b极的电极反应式
②当铜片的质量变化为12.8 g时,a极上消耗的 O2
在标准状况下的体积为( ) L。
(5)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l) == C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l) == C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
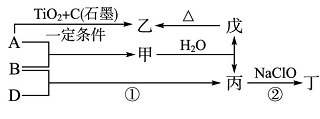
23.已知A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol丁分子中不同原子的数目比为1:2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件已略去)。
请回答:
(1)戊与强碱反应的离子方程式:( )。
(2)NaClO的电子式为( )。
(3)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:( ) 。
(4)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知,该反应生成1mol乙时放出536 kJ热量,其热化学方程式为:( )。
(5) 室温下,0.1mol•L-1氯化铵溶液pH=5.1。若室温下氨水的电离常数Kb=10-x,则x=( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析