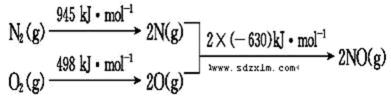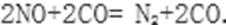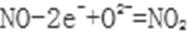- 热化学方程式
- 共127题
24.NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: ______________________。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①写出该反应的热化学方程式: ______________________。
②随温度升高,该反应化学平衡常数的变化趋势是___________。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式: ______________________。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是______________________,元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是___________反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: ______________________。
正确答案
(1)3NO2+H2O=2HNO3+NO
(2)
②K值增大。
(3)
①
②Mg、Ca、Sr、Ba为同一主族元素,从上到下,原子半径逐渐增大元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
(4)
①还原。
②
解析
解析已在路上飞奔,马上就到!
知识点
12.已知:可逆反应N2(g)+3H2(g
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
(1)用CH4和O2直接制备甲醇蒸气的热化学方程式为( )。
(2)某温度下,向4 L恒容密闭容器中通人6 mol CO2和6mol CH4,发生反应(i),平衡体系中各组分的体积 分数均为
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是( ) (填“3.5× 106 Pa""4.0×106 Pa"或“5.0X 106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是( )。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
①通入a气体的电极是电池的( )(填“正”或“负”)极,其电极反应式为( )
②常温下,用此电池以惰性电极电解0.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为( )(忽略溶液的体积变化)。
正确答案
(1)
(2)1;33.3%
(3)
①
②高于
(4)
①负;
②13
解析
解析已在路上飞奔,马上就到!
知识点
28.工业生产尿素过程中涉及的物质转化过程如下图所示。
(1)天然气在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为__________
(2)在合成氨生产中,将生成的氨气及时从反应后的气体中分离出来。运用化学平衡的知识分析这样做是否有利于氨的合成,说明理由:_____________________
(3)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。
①若分别用



②在相同温度下,当压强由p1变为p3时,合成氨反应的化学平衡常数__________(填“变大”“变小”或“不变”)。
③在

(4)



(5)运输氨时,不能使用铜及其合金制造的管道阀门。因为在潮湿的环境中,金属铜在有NH3存在时能被空气中的O2氧化,生成
正确答案
(1)
(2)移走氨气,减小生成物的浓度,平衡右移,有利于氨的合成
(3)①< ②不变 ③66.7
(4)
(5)
解析
解析已在路上飞奔,马上就到!
知识点
27.硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:13℃)。
(1)在第①不反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是_____,原料中的金属钠通常保存在____中,实验室取用少量金属钠需要用到的实验用品有_____,_____,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:
□NaBO2+□SiO2+□Na+□H2===□NaBH4+□Na2SiO3
(3)第②步分离采用的方法是______;第③不分离(NaBH4)并回收溶剂,采用的方法是______。
(4)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25℃,101KPa下,已知每消耗3.8克NaBH4(s)放热21.6KJ,该反应的热化学方程式是_______。
正确答案
(1)除去反应器中的水蒸气和空气;煤油;镊子 ;滤纸
(2)1




(3)过滤;蒸馏
(4)
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析