- 热化学方程式
- 共127题
20.工业上通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
C(s)+O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式___________________。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为________。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解
(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①相同条件下,Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是_______,图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是________。
②由图可得Fe(OH)2的溶度积的值为_________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
19.甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O(g)
II:CO(g) + 2H2(g)
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为:__________________________。
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如下图。
①假设100 ℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1MPa、温度为300℃条件下,将amol CO与3amol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用上图装置模拟上述过程:
① 写出阳极电极反应式 。
② 写出除去甲醇的离子方程式 。
正确答案
(1)CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ•mol-1
(2)
①0.03 mol•L-1•min-1
②2.25×10-4
(3)C、D
(4)
①Co2+—e-=Co3+
① 6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
解析
解析已在路上飞奔,马上就到!
知识点
20.甲醇是极为重要的有机化工原料,在化工、医药、轻工、纺织及运输等行业都有广泛的应用。可以用CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O(g)
II:CO(g) + 2H2(g)
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为:______________________________。
(2)在压强为0.1MPa、温度为300℃条件下,使1molCO与2molH2在催化剂作用下在恒温恒容的容器中发生反应II生成甲醇,下列有关说法正确的是 (填字母序号)。
A.移走CH3OH,平衡正向移动,正反应速率加快
B.反应达平衡后,再加入1molCO与2molH2,CO转化率增大
C.混合气体的密度不变时,说明反应达到平衡
D.平衡后,将容器体积压缩至原来一半,平衡常数K增大
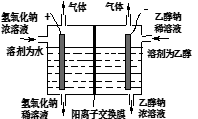
(3)某科研组设计见如图装置,利用电解乙醇和氢氧化钠制取乙醇钠(阳离子交换膜只允许Na+通过)。电解时阳极产成的气体是 ,阴极发生的电极反应式为 。
(4)甲醇对水质会造成一定的污染,可利用Co2(SO4)3氧化除去甲醇,得到CoSO4和一种常见气体。请写出除去甲醇的离子方程式 。
正确答案
(1)CH4(g)+H2O(g) =CH3OH(g) +H2(g)△H=+77.0 kJ/mol
(2)B
(3)O2;CH3CH2OH+2e-=2CH3CH2O-+H2↑
(4)6Co3+ + CH3OH + H2O = CO2↑+ 6Co2+ + 6H+
解析
解析已在路上飞奔,马上就到!
知识点
氨的合成是最重要的化工生产之一。
Ⅰ.工业上合成氨用的H2有多种制取的方法:
① 用焦炭跟水反应:C(s) + H2O(g) 
② 用天然气跟水蒸气反应:CH4(g) + H2O(g) 
已知有关反应的能量变化如下图,且方法②的反应只能在高温下发生,
则方法②中反应的ΔH =___________ kJ/moL。
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g) + N2(g) 
(1) 下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2) 甲容器中达到平衡所需要的时间t 5min (填>、< 或=)
(3) 乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4) 分析上表数据,下列关系正确的是________.
a.2c1 = 3mol/L b.ω1 = ω2 c. 2ρ1 = ρ2
(5) 该温度下,容器乙中,该反应的平衡常数K=__________(用分数表示)(mol/L)-2。
(6) 常温下NH4+(aq) + H2O(l) 
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示。
电池正极的电极反应式是 ,A是 。
(2)用氨合成尿素的反应为2NH3(g) + CO2(g) 


①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
正确答案
Ⅰ.ΔH =+(a+3b-c)
Ⅱ.(1) c
(2) t > 5
(3) 0.2 mol·L-1·min-1
(4) c
(5) K= 4/81
(6) 1.80×10-5mol•L-1
C(NH4+)>C(HC2O4-)>C(H+)>C(C2O42-)>C(OH-)
Ⅲ.N2+8H++6e-=2NH4+;氯化铵
(2) Ⅲ;3
解析
略
知识点
碳及其化合物在科技、社会生产、生活中有着广泛的应用。请按要求回答下列问题:
23.已知:2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1=﹣1214.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) △H2=﹣566 kJ/mol
请写出CH4燃烧热的热化学方程式:______________________________________。
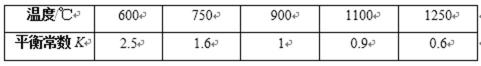
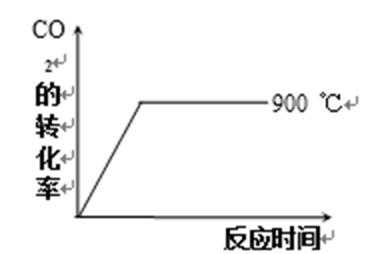
24.在不同温度下反应CO2(g)+H2(g) 
其他条件相同时,请在下图中画出750℃时CO2的转化率随时间变化的示意图。
25.以二甲醚(CH3OCH3)、空气、KOH溶液为原料可设计为燃料电池
①放电时,负极电极反应式:______________________________________。
②假设该燃料电池中盛有100.0 mL 3.0 mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为6.72 L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为_____________________________________________。
正确答案
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol
考查方向
本题考查了热化学方程式的书写及燃烧热的概念
解题思路
根据燃烧热的定义,写方程式是可燃物只能是1mol:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=1/2△H1+1/2 △H2=-890.3 kJ/mol
易错点
忽略可燃物只能是1mol,即燃烧热的定义。
教师点评
本题考查了热化学方程式的书写,盖斯定律的应用及燃烧热的定义,在高考中出现频率高。
正确答案
考查方向
本题考查了化学平衡常数、化学平衡移动,化学反应速率,图像等知识点及学生分析图表获取信息的能力。
解题思路
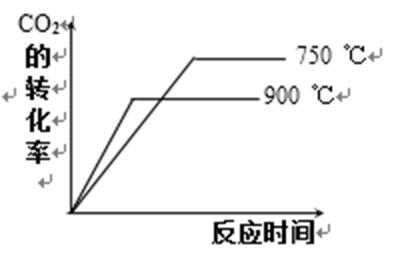
根据第一空,该反应为放热反应,750。C时,温度降低,速率减慢,达到平衡的时间变长,拐点延后,但平衡正移,二氧化碳转化率增大,平台高。
易错点
平衡移动和反应速率的影响结果混淆。
教师点评
本题考查了化学平衡常数、化学平衡移动,化学反应速率,图像等知识点及学生分析图表获取信息的能力。在高考中出现频率较高,但全国卷对该部分内容的考查难度稍大,本题难度较小。
正确答案
CH3OCH3-12e-+ 16OH-=2CO32-+11H2O(2分)
c(K+)>c (HCO3-)>c (CO32-)>c (OH-)>c( H+ ) (1分)
解析
由题意可知:
n(O2)=6.72/22.4 mol =0.3mol n(KOH)=0.3mol
n(e-)=4n(O2)=1.2mol 根据电子得失守恒:
n(CO2)=0.2mol
2KOH+ CO2= K 2 CO+ H 2 O
0.3 0.15 0.15
K 2 CO3+ H 2 O+ CO2=2KHCO3
0.05 0.05 0.1
即最终为n(K 2 CO3)=n(KHCO3)
碳酸钠水解程度大于碳酸氢钠,故得到答案结果。
考查方向
本题考查了燃料电池电极反应式书写、离子浓度大小的比较、计算等知识点。
解题思路
CH3OCH3-12e-+ 16OH-=2CO32-+11H2O
解题步骤:负极二甲醚放电,溶液呈碱性,碳元素的存在形态为CO32-,分析碳元素化合价,写出失去电子数,在根据电荷守恒配平OH-,根据原子守恒配平H2O
燃料电池都可以用这个模式来解题。
第二空见解析。
教师点评
本题考查了燃料电池电极反应式书写、离子浓度大小的比较、计算等知识点。难度较大,考查学生综合能力,在高考中出现频率中等。
以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。以甲醇为原料制取高纯H2是重要研究方向。
22.甲醇在催化剂作用下裂解可得到H2,氢元素利用率达100%,反应的化学方程式为________,该方法的缺点是________。
23.甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g)+H2O(g) 
副反应:H2(g)+CO2(g) 
①既能加快反应速率又能提高CH3OH平衡转化率的一种措施是________。
②分析适当增大水醇比(nH2O∶nCH3OH)对甲醇水蒸气重整制氢的好处________。
③某温度下,将nH2O∶nCH3OH=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为________。(忽略副反应)
④工业生产中,单位时间内,单位体积的催化剂所处理的气体体积叫做空速[单位为m3/(m3催化剂·h),简化为h—1]。一定条件下,甲醇的转化率与温度、空速的关系如图。空速越大,甲醇的转化率受温度影响越________。其他条件相同,比较230℃时1200h—1和300h—1两种空速下相同时间内H2的产量,前者约为后者的________倍。(忽略副反应,保留2位有效数字)
24.甲醇水蒸气重整制氢消耗大量热能,科学家提出在原料气中掺入一定量氧气,理论上可实现甲醇水蒸气自热重整制氢。
已知:CH3OH(g) +

则5CH3OH(g) +4H2O(g) +

正确答案
①CH3OH =催化剂,加热= 2H2 + CO
②混合气体中CO含量较高,会严重缩短电池寿命
解析
认真审题,做出解答。
考查方向
①根据信息,写出相关化学方程式;
②认真审题,找到相关信息用于解答相关问题。
解题思路
①根据信息,写出相关化学方程式;
②认真审题,找到相关信息用于解答相关问题。
易错点
①反应条件容易遗漏或出错;
②没有理解信息,无法做出解答
教师点评
本小题难度不大,要求答题时要细心,不要遗漏。
正确答案
①升高温度、增大H2O(g)浓度等;
②有利于增大CH3OH的转化率、有利于抑制CO的生成;
③
④大;3.2
解析
①综合考虑两种影响因素;
②结合题意,利于提高原料的转化率;结合信息,利于抑制CO的生成;
③计算出原甲醇的分压是

④
考查方向
①考察影响化学平衡、化学反应速率的因素,需要将两者结合考虑。
②结合题意,考察实际采取的措施带来的优点。
③运用相关原理,进行化学平衡的相关计算。
④综合理解,进行相关计算。
解题思路
①综合考虑两种影响因素,需要将方法重叠考虑;
②结合题意,利于提高原料的转化率;结合信息,利于抑制CO的生成;
③运用三段式进行相关计算。
④理解信息,进行计算。
易错点
①容易遗漏相关信息,要从平衡和速率两个角度考虑问题。
②没有结合题意,漏写CO的不利影响
③④不理解信息,不会进行相关计算。
教师点评
本小题难度较大,前两空相对容易得分,后面计算难度很大,若不理解信息,则很难得出正确答案。
正确答案
+3
解析
将第1个热化学方程式乘4,加上第3个热化学方程式,得到结论。
考查方向
考察盖斯定律的综合运用。
解题思路
将第1个热化学方程式乘4,加上第3个热化学方程式,得到结论。
易错点
没有结合上述的相关热化学方程式,没有理解盖斯定律,就不能得到正确结果。
教师点评
盖斯定律的综合运用,难度不大。
4.下列表述和方程式书写都正确的是
正确答案
解析
A. 水为液态时稳定,则乙醇燃烧热的热化学方程式为C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l) =﹣1367.0kJ•mol﹣1,故A错误
B. 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀,说明硫酸根和钡离子的物质的量之比是1:2,离子方程式为:A
C. 浓盐酸可以被酸性高锰酸钾溶液氧化,从而影响双氧水还原性的检验,故C错误
D.硫酸酸化的橙色的重铬酸钾溶液具有强氧化性,能够氧化乙醇,同时生成乙酸和草绿色的三价铬,可以用于检测是否酒后驾驶,反应的离子方程式为::2Cr2O72﹣+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O,故D正确
故本题选择D
考查方向
解题思路
A. 燃烧热的热化学方程式中,水的状态必须为液态
B. 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀,说明硫酸根和钡离子的物质的量之比是1:2
C.浓盐酸可以被酸性高锰酸钾溶液氧化
D. 重铬酸钾在酸性条件下具有强氧化性,能够氧化乙醇,溶液由橙色变为绿色
易错点
配平错误、电荷不守恒
知识点
扫码查看完整答案与解析