- 热化学方程式
- 共127题
硫化物在自然界中的部分循环关系如下。
(1)H2S在空气中可以燃烧。
已知: 2H2S(g) + O2(g) 
S(s) + O2(g) 
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是 。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是 。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会 (填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是 。
④ 在上述反应的同时需要大量鼓入空气,其原因是 。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程: 。
(4)SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是 。
正确答案
见解析。
解析
(1)2H2S(g)+3O2(g) 
(2)① H2SO3

② 降低
③ HCO3 —+ H+ 
④提高脱硫海水的溶解氧,将SO32-氧化成为SO42-,有利于平衡H2SO3

(3)
(4)负极:SO2 - 2e—+ 2H2O 
知识点
下列说法中正确的是
正确答案
解析
略
知识点
如图是某条件时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
正确答案
解析
略
知识点
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)在T℃和mPa时,将0.6molH2和0.4molN2置于一固定容积为2 L的密闭容器中发生反应:
3H2+N2
①0~8分钟NH3的平均生成速率为________mol·L-1·min-1。
②反应3H2+N2
(2)仍在T℃和mPa时,将0.6molH2和0.4molN2置于一容积可变的密闭容器中。(反应过程中保持温度压强不变)
①下列各项能说明该反应已达到平衡状态的是________(填序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.3v(N2)(正) = v(H2)(逆)
c.3v(H2)(正) = 2v(NH3)(逆)
d.混合气体的密度保持不变
e.容器中气体的平均相对分子质量不随时间而变化
②该条件下达到平衡时NH3的体积分数与题(1)条件下NH3的体积分数相比________(填“变大”“变小”或“不变”)
③达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可能是________。
a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
(3)NH3是合成硝酸的基础原料,请写出NH3在催化条件下被O2氧化的化学反应方程式________。
硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。氨气等能将氮氧化物还原为氮气和水,其反应机理为:
2NH3(g)+5NO2(g)=7NO(g) +3H2O(g); △H=-akJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+ 6H2O(g); △H=-bkJ·mol-1
则NH3直接将NO2还原为N2的热化学方程式为:________。
若标准状况下NO与NO2 混合气体40.32L (1.80 mol)被足量氨水完全吸收,产生标准状况下氮气42.56L (1.90 mol)。该混合气体中NO与NO2的体积之比为________。
正确答案
(1)①0.0125;②14.8
(2)①bde;②变小;③c
(3)4NH3+5O2Pt△4NO+6H2O;6NO(g)+4NH3(g)=5N2(g)+6H2O(g)△H=-(6a+7b/5)kJ·mol-1;1﹕2
解析
略。
知识点
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由
空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是__________。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g) + O2(g) 
2SO2(g) + O2 (g) 
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
① 写出NO2和SO2反应的热化学方程式为________。
② 随温度升高,该反应化学平衡常数变化趋势是________。
(3)提高2SO2 + O2
① T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到
平衡,二氧化硫的转化率为50%,该反应的平衡常数是_______。
② 在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是
_________(填字母)。
a.温度和容器体积不变,充入1.0 mol He
b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e. 在其他条件不变时,升高体系温度
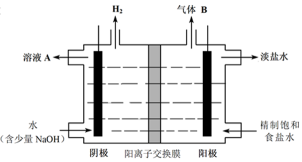
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。下图是氯碱工业中电解饱和食盐水的原理示意图。
① 电解饱和食盐水的化学方程式是 。
② 用溶液A吸收含二氧化硫的废气,其反应的离子方程式是 。
③ 用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是
。
正确答案
见解析。
解析
(1) SO2 + H2O = H2SO3 2 H2SO3 + O2 2H2SO4
(2)① NO2(g) + SO2(g) = SO3(g) + NO(g) △H = -41.8 kJ·mol-1
② 减小
(3) ① 2
② b c
(4)① 2NaCl + 2H2O
② SO2 + OH- =HSO3- (或SO2 + 2OH- =SO32- + H2O)
③ SO2 + Cl2 + H2O =4H+ + SO42- + 2Cl-
知识点
扫码查看完整答案与解析