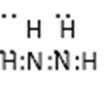- 热化学方程式
- 共127题
化学工艺:电化学是研究两类导体形成的带电界面现象及其上所发生的变化的科学。电化学在化工、冶金、机械、电子、航空、航天、轻工、仪表、医学、材料、能源、金属腐蚀与防护、环境科学等科技领域获得了广泛的应用。下面是在实验室进行电化学实验的相关内容。
已知丙中溶质不止一种,请填写上表并完成下列问题。
29. 甲烧杯中铁电极浸在稀硫酸中却不被氧化,此处所用的金属保护方法是 (具体到类型),以下与上述方法相同的是 ,以下不属于电化学防护方法的是 。
a. 远洋轮船表面镶嵌锌块
b. 在铁表面镀锡制成“马口铁”
c. 大坝船闸钢与电源负极相连
d. 在钢铁中加入铬熔制成不锈钢
30. 若使a、b两电极直接相连,将发生 (选填“析氢”或“吸氧”)腐蚀,实验现象
是 ,设计最简易实验检验该反应所生成的两种产物。
。
31. 丙烧杯中的溶质是 ,若在导线中通过0.06mol电子时,恰好开始产生气体,生成的红色固体为1.28g,则两溶质的初始物质的量之比为 ,此时溶液中的溶质成分为
。并在图中用箭头标出装置中电子的流动方向。
生产前线:“氯胺(NH2Cl)消毒法”是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2 + NH3 →NH2Cl + HCl,生成的NH2Cl能部分水解生成强氧化性的物质,起消毒杀菌的作用。
32. ① 氯胺能用于消毒杀菌的原因是 (用化学方程式表示)。
② 经氯胺消毒法处理后的水中,氮元素多以NH4+ 的形式存在。
已知:NH4+(aq)+1.5O2(g)→NO2-(aq)+2H+(aq)+H2O(l)+273 kJ
NH4+(aq)+2O2(g)→NO3-(aq)+2H+(aq)+H2O(l)+346 kJ
则NO2-(aq)被O2氧化成NO3-(aq)的热化学方程式为 。
33. 用水稀释0.1mol/L氨水,溶液中随着水量的增加而增大的是 。
a. 
b.
c. c(H+)·c(OH-)
d.
34. 铝铵矾[NH4Al(SO4)2•12H2O]也是常用的工业净水剂,其净水的化学原理是 (用离子方程式表示)。在向铝铵矾溶液中逐滴滴加氢氧化钡溶液的过程中,下列关系可能正确是 。
a. n(SO42-)>n(NH4+)>n(Al3+)>n(OH-)
b. n(Al3+)>n(NH4+)>n(SO42-)>n(H+)
c. n(BaSO4)>n[Al(OH)3]>n(NH3·H2O)>n(AlO2-)
d. n(NH3·H2O)>n(BaSO4)>n[Al(OH)3]>n(AlO2-)
另一常用净水剂高铁酸钾(K2FeO4)在净水过程中除了与铝铵矾相似的化学原理和作用之外,它的另一作用是 ,这体现了它的 (填写性质)。
正确答案
见解析。
解析
29. 外加(接)电流(电源负极)的阴极保护法;c;bd(提示:b化学保护法,d是改变内部结构,非电化学法)
30. 析氢;铁片溶解,石墨上有气泡;爆鸣实验:收集一试管正极气体(H2),用拇指捂住试管口慢慢移动至酒精灯上方,松开拇指后听到“噗”声则说明是纯净的氢气(写还原氧化铜等,不符合“简易”,不给分);取负极附近溶液于试管,先滴加硫氰化钾溶液,溶液不变色,再滴加氯水,溶液变为血红色,则说明生成Fe2+离子(要取样,要排除三价铁,所以顺序不能颠倒)
31. 硫酸铁、硫酸铜[Fe2(SO4)3、CuSO4];1:2(对应);硫酸亚铁、硫酸(FeSO4、H2SO4)三个箭头
32. NH2Cl+H2O→NH3+HClO;2NO2-(aq)+O2(g)→2NO3-(aq)+146 kJ
33. d
34. Al3++3H2O
知识点
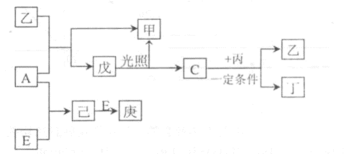
27. A、B、C、D、E为五种元素的单质,其余为化合物。其中只有E为金属元素,五种元素的原子序数按B、D、C、A、E顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙每个分子中均含有10个电子,下阁为相互转 化关系:
谘回答下列问题:
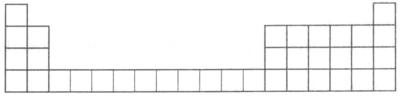
(1)下面是周期表的一部分,请将A、C、E用元素符号填在相应的位置上。
(2)写出工业上制取A反应的离子方程式_______________
(3)戊的分子式为_______.B与D形成的原子个数比为2:1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式______
(4)A与丙常温下发生反应生成甲与单质D,该反应的化学方程式_________
(5 )8gE在A中燃烧放山热摄QkJ,写出该反应热化学方程式________(热量是常温下测定的)。
(6)实验室配制庚溶液的实验方法是________。
正确答案
见解析。
解析
(1)
(2)
(3)HClO
(4)
(5)
(6)向盐酸中加入适量的FeCl2晶体,搅拌溶解,然后加水稀释,并加入少许铁粉。
知识点
碱式氯化铝[ Al2(OH)nCl6-n ] 是利用工业铝灰和活性铝矾土为原料(主要含Al、Al2O3、SiO2及铁的氧化物)经过精制加工而成,此产品活性较高,对工业污水具有较好的净化效果。其制备流程如下:
(1)原料需要粉碎,其目的是 ;滤渣I的主要成分是 ;
(2)步骤①在煮沸过程中,溶液逐渐变为浅绿色,此时溶液中呈浅绿色的阳离子常采用
加入 试剂进行检验(填化学式);随后溶液又变为棕黄色,相关反应
的离子方程式为 ;
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成碱式氯化铝;二是
;已知碱式氯化铝的分散质粒子大小在1~100 nm之间,则区别滤液I与碱式氯化铝两种液体的物理方法是 ;若Ca(OH)2溶液过量,则步骤③得到的碱式氯化铝产率偏低,该反应的离子方程式为 ;
(4)某温度下若0.1 mol AlCl3溶于蒸馏水,当有2.5%水解生成Al(OH)3溶液时,吸收热
量Q kJ ,该过程的热化学反应方程式为 。
正确答案
见解析。
解析
(1)增大反应物接触面积,加快溶解速率(提高Al3+的浸出率);
SiO2 (或:二氧化硅) ;
(2)K3[Fe(CN)6] ; 4Fe2+ +O2 + 4H+= 4Fe3+ + 2H2O ;
(3)除Fe3+ ; 观察是否有丁达尔效应;
Al3+ + 4OH-=AlO
(4)
知识点
3.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )
正确答案
解析
略
知识点
氮元素的化合物种类繁多,性质也各不相同。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
则NO2氧化SO2的热化学方程式为________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:2NH3(g)
则平衡时氨气的转化率为________。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。在空气中完全燃烧生成氮气,当反应转移0.2mol电子时,生成气体在标准状况下的体积为________。联氨溶于水可以发生与氨水类似的电离,试写出联氨在水溶液中的电离方程式:________(写一步即可)。
(4)NH4+在溶液中能发生水解反应。在25℃时,0.1mol/L氯化铵溶液由水电离出的氢离子浓度为1×10-5 mol/L,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3·H2O)=________。
正确答案
(1)NO2(g)+SO2(g)
(2)40%
(3) 1.12L;N2H4+H2O
(4) Kb(NH3·H2O)=1×10-5mol/L
解析
略。
知识点
硫元素的含氧酸盐在工业上用途广泛,完成下列填空。
工业上用Na2SO3溶液处理工业尾气中的SO2,下表数据表示反应过程中
(1)简述
(2)已知:Ki1(H2SO3)> Ki(HAc) > Ki2(H2SO3) > Ki2(H2CO3),要使NaHSO3溶液中c(Na+):c(HSO3-)接近1:1,可在溶液中加入少量____________。
a.H2SO3溶液 b.NaOH溶液 c.冰醋酸 d.Na2CO3
(3)实验室通过低温电解KHSO4溶液制备过二硫酸钾K2S2O8,写出熔融KHSO4的电离方程式:__________________________________________。
(4)S2O82-有强氧化性,还原产物为SO42-,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。书写此反应的化学方程式:_________。
(5)已知:S2O32-有较强的还原性,实验室可用I-测定K2S2O8样品的纯度:反应方程式为:
S2O82-+2I-→2SO42-+I2 ……① I2+2S2O32-→2I-+S4O62- ……②
S2O82-、S4O62-、I2氧化性强弱顺序:__________________________。
(6)K2S2O8是偏氟乙烯(CH2=CF2)聚合的引发剂,偏氟乙烯由CH3—CClF2气体脱去HCl制得,生成0.5 mol偏氟乙烯气体要吸收54 kJ的热,写出反应的热化学方程式_______。
正确答案
(1)HSO3-的电离程度与SO32-的水解程度相近 0.2 mol/L
(2) a c
(3)KHSO4 →K+ + HSO4-
(4)5K2S2O8 + 2MnSO4 + 8H2O → 4K2SO4 + 2KMnO4 + 8H2SO4
(5)S2O82- > I2 > S4O62-
(6)CH3—CClF2(g) → CH2=CF2(g) + HCl(g)–108kJ
解析
略
知识点
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2)中钒的主要流程如下:
已知:(1)V2O5和NH4VO3均为难溶物,VOSO4和(VO2)2SO4均为易溶物;
(2) 2VO2++H2C2O4+2H+ = 2VO2+ + 2CO2↑+ 2H2O。
回答下列问题:
(1)步骤①前,粉碎的目的是________。
(2)步骤②中发生反应的离子方程式为________。
(3)步骤③的变化过程可简化为(HA表示有机萃取剂):VOSO4 (水层)+ 2HA(有机层)
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定操作⑤后溶液中含钒量的步骤为:取10.0mL0.1mol/LH2C2O4溶液于锥形瓶中,加入指标剂,将待测液盛放在滴定管中,滴定到终点时,消耗待测液的体积为10.0mL,由此可知(VO2)2SO4溶液钒元素的含量为________g/L。
(5)V2O5可用金属(如Ca、Al)热还原法获得钒,则金属铝热还原制得钒的化学方程式为________。
正确答案
(1)增大固液接触面积,加快浸出速率,提高浸出率
(2) V2O5+ SO32-+4H+=2VO2+ + SO42-+2H2O
(3)加入硫酸,可使平衡向左进行,使VOSO4进入水层
(4) 10.2g/L
(5)3V2O5+10Al
解析
略。
知识点
氮是地球上含量丰富的一种元素,氯及其化合物在工农业生产,生活中有着重要作用。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图:
请写出NO2和CO反应的热化学方程式______________________________________。
(2)在一定体积的密闭容器中,进行如下反应:N2(g)+3H2(g)→2NH3(g)+Q(Q>0),
其化学平衡常数K与温度T的关系如下表:
比较K1、K2的大小:K1_______K2(填“>”、“=”或“<”);
判断该反应达到化学平衡状态的依据是____(选填序号)。
a.2v(H2)正=3v(NH3)逆 b.2v(N2)正=v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)盐酸肼( N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。盐酸肼第1步水解反应的离子方程式为__________________________;盐酸肼水溶液中各离子浓度的关系正确的是____(填序号)。
a.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
b.c(Cl-)>c([N2H5•H2O]+)>c(H+)>c(OH-)
c.2 C(N2H62+)+ c([N2H5•H2O]+)+c(H+)=c(Cl-)+c(OH-)
d.2 c(N2H62+) +2 c([N2H5•H2O]+)+2c([N2H4•2H2O)= c(Cl-)
正确答案
(1)NO2 (g)+CO( g) →CO2 (g)+NO(g) +234 kJ
(2)> ;a、c
(3) N2H62++ H2O→[N2H5•H2O]++ H+
a、c、d
解析
略
知识点
28.工业上“固定”和利用CO2能有效地减轻“温室’效应。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g) 
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是()
A. n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
(2)一定温度时将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
① a点正反应速率()逆反应速率(填“大于”、“等于”或“小于”)。
② 仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是(),曲线Ⅱ对应的实验条件改变是()。
③ 在题给图中绘出加入催化剂对应的曲线。
④ 结合图给实线的数据,计算该温度时反应的化学平衡常数。(写出计算过程)
(3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为()。
正确答案
见解析。
解析
(1) BC(3分,只选B或C得1分,全对得3分,凡其它有错答案不得分)
(2) ① 大于② 升高温度 增大压强
③
④
(3)CH3OH+8OH--6e-=CO32-+ 6H2O( 2分,未配平扣1分)
知识点
大气中可吸入颗粒物PM2.5主要来源为燃煤、机动车尾气等。
(1)若取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,则该溶液为 ___________(填“酸性”或“碱性”)溶液,其原因用离子方程式解释是:__________ 。
(2)“洗涤”燃煤烟气可减轻PM2.5中SO2的危害,下列可适用于吸收SO2的试剂有__________
a.CaCl2溶液
b.氨水
c.Ca(OH)2悬浊液
d.浓H2SO4
(3)煤烟气中的氮氧化物可用CH4催化还原成无害物质。若常温下,1molNO2与CH4反应,放出477.5kJ热量,该反应的热化学方程式是__________ 。
(4)安装汽车尾气催化转化器也可减轻PM2.5的危害,其反应是:__________
2NO(g) + 2CO(g) 
①该反应平衡常数表达式K=__________;温度升高K值__________(填“增大”或“减小” )
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是__________ 。
(5)使用锂离子电池为动力汽车,可减少有害气体的排放。锰酸锂离子蓄电池的反应式为:
Li1-xMnO4 + LixC
下列有关说法正确的是__________
a.充电时电池内部Li+向正极移动
b.放电过程中,电能转化为化学能
c.放电时电池的正极反应式为:Li1-xMnO4+xe—+xLi+=LiMnO4
d.充电时电池的正极应与外接电源的负极相连
正确答案
见解析。
解析
(1)酸性,NH4++H2O
(2)b c
(3)2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l);△H= -955kJ/mol
(4)①
(5)c
知识点
扫码查看完整答案与解析