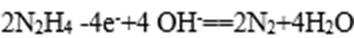- 热化学方程式
- 共127题
化合物


(1)已知




(2)反应


①列式计算实验a从反应开始至达到平衡时的反应速率 v(
②图中3组实验从反应开始至达到平衡时的反应速率v(
③用

正确答案
(1)
(2)①
②bca;加入催化剂。反应速率加快,但平衡点没有改变;温度升高。反应速率加快,但平衡点向逆反应方向移动(或反应容器的溶剂和起始物质的量未改变,但起始总压强增大)
③
解析
略。
知识点
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2H4 (1) △H1= -19.5kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2H4 反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
正确答案
(1)5
(2)2NH3+NaClO==N2H4+NaCl+H2O
(3)2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H2= -1048.9kJ·mol-1
(4)
解析
(1)N原子的原子结构示意图为: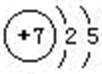
(2)NH3+NaClO——N2H4,根据元素守恒还应生成NaCl和H2O,观察法可配平方程式为 2NH3+NaClO==N2H4+NaCl+H2O;
(3)肼与N2O4反应生成N2和水蒸气:2N2H4 +N2O4==3N2+4H2O,观察已知的两个热方程式可知,②×2-①得:2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H2= -1048.9kJ·mol-1
(4)“肼一空气燃料电池是一种碱性电池”中O2在正极反应,故负极是肼发生反应:
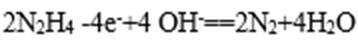
知识点
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量CO2)直接制备二甲醚,其中主要过程包括下列四个反应:
甲醇合成反应:
(i)CO(g)+2H2(g)=CH3OH(g) △H1=-90.1 kJ/mol
(ii)CO2(g)+3H2(g)=CH3OH(g)+H2O △H2=-40.9 kJ/mol
水煤气变换反应:
(iii)CO(g)+H2O(g)= CO2(g)+H2(g) △H3=-41.1 kJ/mol
二甲醚合成反应:
(iv)2CH3OH(g)= CH3OCH3(g)+H2O △H4=-24.5 kJ/mol
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂主要成分之一。工业上从铝土矿制备高纯Al2O的主要工艺流程是 。(用化学方程式表示)
(2)分析二甲醚合成反应(iv)对CO转化率的影响 。
(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。根据化学反应原理,增加压强对直接制备二甲醚的反应的影响 。
(4)有研究者在催化剂(含Cu-Zn-Al-O、Al2O3)、压强在5.0Mpa条件下,由H2和CO直接制备二甲醚,结果如图所示。其中CO转化率随温度升高而降低的原因是 。
(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为 。一个二甲醚分子经过电化学氧化,可以产生 个电子的电量:该电池理论输出电压为1.20V,能量密度E= (列式计算,能量密度=电池输出电能/燃料质量)。
正确答案
(1)Al2O3+2NaOH+3H2O=2NaAl(OH)4
NaAl(OH)4+CO2=Al(OH)3+NaHCO3、2 Al(OH)3
(2)消耗甲醇,促进甲醇合成反应(i)平衡向右移,CO转化率增大:生成的水通过水煤气变换反应(iii)消耗部分CO。
(3)2CO(g)+4H2(g)=CH3OCH3(g)+H2O △H=-204.7 kJ/mol;该反应分子数减小,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加,压强升高使CO和H2浓度增大,反应速率加快。
(4)反应放热,温度升高,平衡左移。
(5)CH3OCH3+3H2O=2CO2+12H++12e-;12;
解析
略
知识点
W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。
(1)X位于元素周期表中第______周期第______族;
(2)X的单质和Y的单质相比,熔点较高的是______(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是______(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是______。
(4)在25°C、101kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190.0kJ,该反应的热化学方程式是______。
正确答案
(1)3;IA;2
(2)Si;HCl
(3)SiCl4+3H2O =H2SiO3↓+3HCl
(4)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-760kJ/mol
解析
本题综合考查元素周期表、晶体结构、元素化合物知识以及热化学方程式等知识。
根据题意,不难推出W为氧,X为钠,Y为硅,Z为氯。
知识点
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: 33CH4(g)+H2O(g)=CO(g)+3H2(g) △H=206.2kJ·mol-1
33CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) △H=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_________。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是_________。燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:_________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图11所示。图中A、B表示的物质依次是_________。
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图12(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为_________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为_________。
正确答案
(1)CH4(g)+2H2O(g) =CO2(g) +4H2(g) △H=165.0 kJ·mol-1
(2)为H2S热分解反应提供热量;2H2S+SO2 =2H2O+3S (或4H2S+2SO2=4H2O+3S2)
(3)H、O(或氢原子、氧原子)
(4)CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
(5)2Mg2Cu+3H2
解析
略。
知识点
扫码查看完整答案与解析