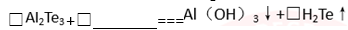- 热化学方程式
- 共127题
27.下表是氧族元素的相关性质
请根据表回答下列问题:
(1)硒的熔点范围可能是( )。
(2)氢硒酸有较强的( )(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生在化学反应方程式为( ) 。
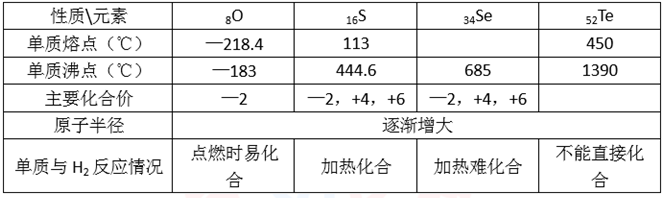
(3)工业上可用来制备H2Te,完成下列化学方程式:
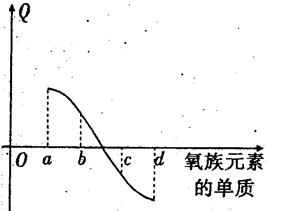
(4)已知在常温下,H2和S反应生成17gH2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式:( ) 。
(5)下图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分另表示氧族中某一元素的单质,Q为相同物质的量的单质与H2反应放出的热量。则:a代表( ),c代表( ) (均可单质名称)
27.下表是氧族元素的相关性质

(1)硒的熔点范围可能是
(2)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生在化学反应方程式为 。
(3)工业上
□
(4)已知在常温下,H2和S反应生成17gH2S放出
56.1KJ的热量,试写出硫化氢分解的热化学方
程式: 。
(5)右图所示为氧族元素单质与H2反应过程中的
能量变化示意图,其中a、b、c、d分另表示
氧族中某一元素的单质,Q为相同物质的量
的单质与H2反应放出的热量。则:
a代表 ,c代表
(均可单质名称)
正确答案
正确答案
27.乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制取:

(1)在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是( )(填字母序号)。
a. 生成1 mol CH3CH2OH的同时,生成3 mol H2O
b. 体系中各组份的物质的量浓度不随时间而变化
c. 体系中混合气体的密度不随时间而变化
d. 体系中气体的分子总数不随时间而变化
e. 体系中的气体的总压强不随时间而变化
(2)上述反应的化学平衡常数的表达式为( )。当温度T1 >T2 时,化学平衡常数K 1 ( )K2(填“>”、“<”或“=”)。
(3)在恒温、体积固定的某密闭容器中加入2 mol CO2和6 mol H2,达到平衡后测得CH3CH2OH为0.5 mol,则H2的转化率为( ),如果再向该容器充入1mol CO2和3 mol H2,平衡会向( )(填“正向移动”、“逆向移动”或“不移动”),再次达到平衡时,CO2的转化率会 ( )(填“增大”、“减小”或“不变”)。
(4)在工业生产中,可使H2的转化率和化学反应速率同时提高的措施有:________(写出一条合理措施即可)。
(5)已知:0.5 mol 乙醇液体燃烧生成二氧化碳和水蒸气,放出的热量为617.1 kJ/mol,又知H2O(l)== H2O(g) ΔH =+44.2 kJ/mol,请写出乙醇液体完全燃烧生成液态水的热化学方程式 ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.下列叙述与对应图式正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.砷(As)广泛分布于自然界,其原子结构示意图是
(1)砷位于元素周期表中( )族,其气态氢化物的稳定性比NH3 ( )(填“强”或“弱”)。
(2)砷的常见酸性氧化物有As2O3和As2O5,根据下图写出As2O5分解为As2O3的热化学方程式:( )。
(3)砷酸盐可发生如下反应:AsO


① A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转。此时C2上发生的电极反应式为 ( ) 。
② 一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针( )(填“不动”、“向左偏”或“向右偏”)。
正确答案
(1)
(2)
(3)① 
解析
解析已在路上飞奔,马上就到!
知识点
23.甲、乙、丙、丁四种物质转化关系如右图。已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素。
(1)若乙是难溶于水的酸性氧化物。
①乙的一种重要用途是( );
②丙溶液中通入少量CO2生成丁的离子方程式是( )。
(2)若2乙(g) + 甲(g) 
①该反应的△H( )0(填“>”、“<”或“=”,下同);
②若400℃和500℃的化学平衡常数分别为K1、K2,则K1 ( ) K2。
(3)若丙是离子化合物,且阴离子含金属元素R。
①R的原子结构示意图是( );
②已知:R(s) + 

Mn(s) + O2(g) = MnO2(s) △H=-520.9 kJ·mol -1
写出R的单质与MnO2反应的热化学方程式( ) 。
正确答案
(1)①制造光导纤维或生产玻璃等(其他合理答案均给分)
(2)
(3)
解析
解析已在路上飞奔,马上就到!
知识点
27.物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
(1)若A为硫酸工业的重要原料,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则:
①工业上反应II在( )中进行(填设备名称),工业上反应III用于吸收E的试剂是( ) 。
②反应I的化学方程式是( )。

①A的电子式是( )。
②写出D和乙反应的离子方程 式:( ) 。
③25℃时,在右图装置中的小烧杯里先倒入50mL 0.50mol/L G的稀溶液,然后一次加入50mL 0.55 mol/L D的稀溶 液,经测定反应中放出的热量为1.4kJ,反应的热化学方程为:( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%
(1)用于净化汽车尾气的反应为:
A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B.提高尾气净化效率的常用方法是升高温度
C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率
D.提高尾气净化效率的最佳途径是使用高效催化剂
(2)CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。镍与CO反应的化学方程式为
则用SO2除去CO的热化学方程式为_____________________________________。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是: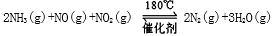
(4)利用ClO2 氧化氮氧化物反应过程如下: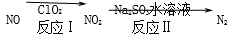

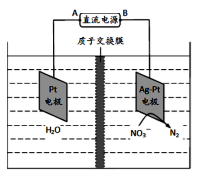
(5)化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。其原理如下图所示。
电源负极为( )(填A或B),阴极反应式为( );若电解过程中转移了2mol电子,则质子交换膜左侧极室电解液的质量减少( )克。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
31. Ⅰ.已知:4Al(s)+3O2(g) = 2Al2O3(s) △H=-2834.9KJ•mol-1
写出铝与氧化铁发生铝热反应的热化学方程式( ) 。
Ⅱ.在2L密闭容器内,800℃时反应:
(1) 写出该反应的平衡常数表达式:K= ( ); 用

(2)下列研究目的和示意图相符的是( )。
III.科学家制造出一种使用固体电解质的高效燃料电池。一个电极通入空气,另一个电极通入燃料蒸汽。其中固体电解质是掺杂了


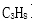
(1)电池的负极反应式为( );
(2)放电时固体电解质里的
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27. 现有甲、乙、丙、丁四种物质,其构成微粒均含有14个电子。已知甲是固体单质,乙是只含非极性共价键的气体分子,丙是四原子分子,丁是一种离子化合物,且阴离子半径大于阳离子半径。
(1)甲形成的晶体属于( )(填晶体类型);丙分子的空间构型是( ) 。
(2)丁的电子式为( )。
(3)已知丙的燃烧热为akJ·mol-1,请写出丙燃烧反应的热化学方程式 ( ) 。
(4)物质甲、乙存在相互关系如图(单质F是一种常见金属)
请写出下列方程式:
①甲与NaOH溶液的离子反应:( ) ;
②乙与单质F的化学反应:( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。
回答下列问题:
(1)组成单质Z的元素在周期表中的位置是( ); R的化学式是( );
(2)E、Z的晶体类型均属于( )晶体。E、Z结构中最小的环上原子个数之比为( )。B为一元强碱,焰色反应为紫色,则B的电子式为( )。
(3)写出下列反应的化学方程式:
①单质Z与 NaOH的反应:( ),
②工业上由E制取粗Z:( ),
(4)已知A与1 mol Al反应转化为X时(所有物质均为固体),放出a kJ 热量,写出该反应的热化学方程式:( )。
(5)向A与X的混合物中加入100 mL 1mol / L盐酸恰好使混合物完全溶解,放出标准状况下的气体224 mL,在溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到单质的质量为( ) 。
正确答案
(1)第三周期IVA族 ;
(2)原子 ; 2:1 ;
(3)
(4)
(5)2.8g
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析