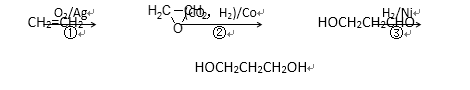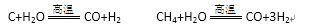- 热化学方程式
- 共127题
13.二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能;二甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol;工业上用合成气(CO、H2)直接或间接制取二甲醚。下列叙述正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28. A、B、C为三种短周期元素,核电荷数依次增大,且A、B、C三种元素的原子核外电子层数之和为5。已知A是原子结构最简单的元素,B元素原子最外层上的电子数是其电子层数的2倍,A和C之间可形成A2C和A2C2两种化合物。请回答下列问题。
(1)C元素在元素周期表中的位置是 ( );
(2)化合物A2C2的电子式为( )。
(3)常温下,三种由A与B形成的气态化合物X、Y、Z,它们分子中A与B的原子个数皆满足N(A)=2N(B)+2,且B原子个数小于或等于4。当化合物质量满足2m(Y)=m(X)+m(Z),完全燃烧生成B的最高价氧化物时消耗O2的物质的量同时满足2n(Y)=n(X)+n(Z)。则Y的化学式可能为( ),若X、Y、Z中B原子个数比为1∶2∶3,则Z的化学式为( )。
(4)有机化合物E、M分子式不同,它们可能含A、B、C元素中的两种或三种。如果将E、M无论以何种比例混合,只要其物质的量之和不变,与氧气完全反应生成的B的最高价氧化物和消耗的氧气的物质的量也不变。则E、M组成必须满足的条件是( )。
(5)已知在101kPa时,15.0 g Y(分子中B原子数小于3)在氧气中完全燃烧生成BC2和A2C,放出热量324 kJ(25℃时),Y的燃烧热化学方程式是:
_____________________________________________________________________。
(6)Y ─ 空气燃料电池是一种碱性燃料电池。(Y分子中B原子数小于3)电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:
负极的电极反应式______________________________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
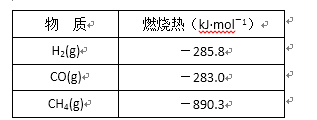
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表:
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反
应的热化学方程式 ( )。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 mol H2,,此时N2的转化率为a。则平衡时NH3的浓度为 ( )。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭( )吨、甲烷( )吨,才能满足生产需要。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.(14分)合成氨和制备硝酸是两种重要的化工生产,四川某化工厂将合成氨与制备硝酸进行连续生产。其工艺流程见右图:
(1)在某温度下体积为200L的氨合成塔中,以分为单位的时间点上测得各物质的浓度(mol·L-1)如下表:
根据表中数据得知0 min~2 min内N2的平均反应速率是( ),若用CH4与过量水蒸气反应来制氢气,再与氮气合成氨,则理论上CH4与NH3的物质的量之比是( )。
(2)今对合成氨反应进行如下研究:
在容积均为10L的a、b、c三个相同密闭容器中分别充入1mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5min时,NH3的体积分数如右图所示。则下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.有A、D、E、X、Y、Z、W七种元素,其中A、D、E、X、Y、Z是原子序数依次增大的短周期主族元素。X原子最外层电子数是其内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用;W是一种常见的金属,其元素的含量位于地壳中元素含量的第四位。
⑴ Y形成的简单阴离子结构示意图为( ▲ ) 。
⑵ 甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键,常温下甲是一种无色液体。甲在碱性溶液中能够将CuO还原为Cu2O,已知当1mol甲完全参加反应时转移了4 mol电子,则该反应的化学方程式可表示为: ( ▲ )。
⑶ 处理含DX、YX2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质Y。已知反应生成 1 gY固体单质时放出8.4kJ热量,
此反应的热化学方程式为( ▲ )。
⑷ 由钠和X、Z三种元素组成的一种阴、阳离子个数之比为1 :1的化合物乙,其溶液显碱性,则该化合物所含的化学键类型有( ▲ ) 。将化合物乙加入到WZ2的溶液中,当转移2mol电子时,溶液中发生的离子反应方程式为:( ▲ )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析