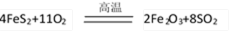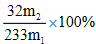- 物质的量浓度的计算
- 共63题
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是
正确答案
解析
略
知识点
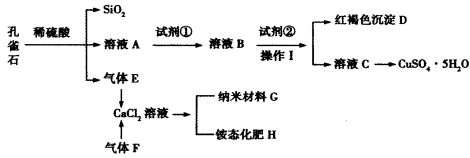
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O及纳米材料G,主要步骤如下:
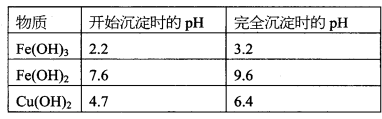
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+沉淀完全。Fe3+、Fe2+、
Cu2+开始沉淀及完全沉淀的pH分别如下:
请回答下列问题:
(1)孔雀石主要成分Cu2(OH)2CO3与稀硫酸反应的化学方程式为_______________。
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。要检验其中的Fe2+应选择下列试剂中的___________(填序号)。
a。KMnO4 b。NaOH C。H2O2 d。KSCN
(3)试剂①是一种氧化剂,加入该氧化剂的作用是______________;
(4)向溶液B中加入试剂②的化学式为__________________。
(5)气体E和气体F应该先通入CaCl2溶液中的是_______________(填化学式)。写出制备G和H的化学反应方程式______________。
(6)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中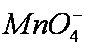
mol/L KMnO4溶液16。00 mL时,恰好达到滴定终点,则A溶液中Fe2+浓度为________。
正确答案
(1)Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑
(2)a
(3)将溶液中的Fe2+氧化为Fe3+(以便在Cu(OH)2沉淀之前,通过调节溶液pH使Fe(OH)3沉淀完全)
(4)CuO或Cu(OH)2或CaCO3 或Cu2(OH)2CO3 (写一种即可,多写且正确不扣分)
(5)NH3 2NH3+CO2+CaCl2+H2O==CaCO3↓+2NH4Cl
(6)MnO4- + 5Fe2+ + 8H+=== Mn2+ + 5Fe3+ + 4H2O 0.0960mol/L
解析
略。
知识点
某溶液中含有大量的Cl一、Br一、I一,若向l L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br一、I一的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,原溶液中Cl一、Br一、I一的物质的量浓度之比为
正确答案
解析
略
知识点
硝酸工业尾气中氮氧化物(NO 和NO2)是主要的大气污染物之一,可用氨氧混合气体进行选择性还原处理。其主要反应原理如下:
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已换算成标准状况),其中NO NO2的物质的量比为41。设尾气中氮氧化物与氨氧混合气恰好完全反应。
(1)尾气中氮氧化物的平均相对原子量为_____________;尾气中NO的含量为_____mg/m3。
(2)要处理5m3的尾气,需要氨氧混合气的体积为_______L。
(3) 另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积25%NaOH溶液(密度1.28g/cm3)完全吸收。NaOH溶液的物质的量浓度为_____________mol/L,体积为_____mL。
(4)已知反应后溶液含有0.35molNaNO2。若将尾气NO 和NO2的平均组成用NOx表示,则x=
正确答案
(1) 33.2, 1800
(2)10.64L
(3) 8 , 62.5
(4) 1.8
解析
略
知识点
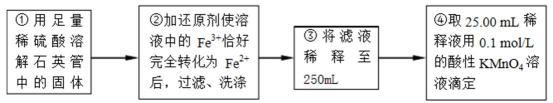
黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。
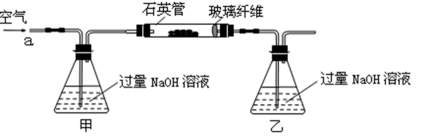
将m 1 g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:
【实验一】:测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
(1)甲、乙两装置的作用分别是_______、_______;
乙瓶内发生反应的离子方程式为_______、_______;
(2)反应后乙瓶中的溶液需加足量H2O2溶液的目的是_______。
(3)该黄铁矿石中硫元素的质量分数为_______。
【实验二】:测定铁元素的含量
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量_______(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_______。
(6)某同学一共进行了三次滴定实验,三次实验结果记录如下:
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______。
正确答案
见解析。
解析
(1)除去空气中的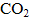
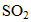
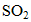
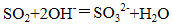
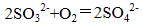
(2)使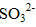
(3)
(4)偏大
(5)250mL容量瓶
(6)0.5mol/L
知识点
扫码查看完整答案与解析