- 物质的量浓度的计算
- 共63题
8.下列各表述与示意图一致的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
20.向1LAlCl3 和FeCl3的混合溶液中加入含a mol NaOH的溶液时,产生的沉淀可达到最大值;继续加入NaOH的溶液,沉淀开始溶解,当前后加入的NaOH的物质的量达到b mol时,沉淀量不再变化。求原溶液中Fe3+的物质的量浓度。
正确答案
因为
依题意得
解得
解析
解析已在路上飞奔,马上就到!
知识点
13. 已知298K时,Mg(OH)2的溶度积常数为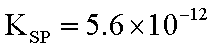
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.超细碳酸钙,粒径范围为1—100nm,其应用非常广泛。下图为某化工企业生产超细碳 酸钙的工业流程图:
供选择的药品:①石灰石②氯化铵③氢氧化钙④饱和氯化钙溶液⑤浓硫酸⑥6 mol/L盐酸⑦饱和食盐水⑧饱和NaHCO3溶液。
试回答以下问题:
(1)装置C中的发生反应的离子方程式为( )。
(2)打开分液漏斗活塞与点燃酒糟灯,在实验中应该先行操作的为( )(填“前者”或“后者”)。
(3)过滤洗涤烘干出C中的碳酸钙固体,设汁实验验证产品是否为超细碳酸钙?( ) 。
(4)该装置逛可模拟侯氏制碱法,则在(装置中产生的沉淀酌化学式为( ) 。
(5)写出E中发生的化学反应方程式( ) 。F试管中的现象为无色溶液先出现沉淀,一段时间后沉淀重新溶解,F中反应漪所装的溶液可能为( )。
(6)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收。另一个作用和图I装置中的一个设计作用相同,请写出图l中相同作用的设计( ) 。
(7)精制工业氯化钙溶液通常方法为加入少量石灰乳除去杂质Mg2+,方程式为:

已知:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体。实验 室常用铬酸氧化环己醇制备,但铬酸较贵且污染环境。某化学兴趣尝试用中学化学更常见的次氯酸钠代替铬酸制备环己酮。有关物质信息、实验流程及实验装置如下:
环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,密度(相对水=1):0.95,熔点:-45℃,沸点:155℃,溶解度(100mL H2O):2.4g (31℃)。

回答下列问题:
(1)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有 ( )。
(2)加入饱和NaHSO3溶液时发生的主要反应是( ) (用离子方程式表示),确保加入的饱和NaHSO3溶液已经足量的实验操作是(
)。
(3)为将馏出液的pH调至中性,可以加入的试剂是( ) 。
(4)调节pH后还需加入精制食盐,其目的是( ),“取有机层”时使用的主要仪器是( ) 。(填下图对应的字母)。
(5)实验条件的优化对实验成败至关重要,小组成员觉得有必要对NaClO溶液的最佳浓度进行探究。他们配制了一系列不同浓度的NaClO溶液,并用滴定法标定。具体方法是:用移液管取10.00mL NaClO溶液于500mL容量瓶中定容,取25.00mL于锥形瓶中,加入适量稀盐酸和KI固体(足量),用0.1000mol/L Na2S2O3标准溶液滴定至终点(用淀粉溶液作指示剂),三次平行实验平均消耗Na2S2O3标准溶液18.00mL,已知I2+2Na2S2O3==2NaI+Na2S4O6 。则该NaClO溶液的浓度是( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析